Research Progress on Influencing Factors and Mechanisms of Chromium Valence State Transformation in Soil
-
摘要:
土壤中铬(Cr)污染是全球性环境问题,六价铬Cr(Ⅵ)因其高毒性及致癌性而成为关注焦点。土壤中的Cr主要以Cr(Ⅲ)和Cr(Ⅵ) )的形式存在,两者之间的转化受到诸如土壤pH值、氧化还原电位(Eh)、天然氧化还原剂、有机质和微生物的影响。随着工农业活动的增多,土壤中的Cr浓度不断增加,并通过植物吸收进入食物链等多种途径,对生态系统和人体健康构成威胁。本文对Cr在全球范围内的污染现状及来源、土壤中Cr的不同价态及其毒性特征进行了评述,并分析了pH、Eh对土壤中Cr的具体存在形态与价态的影响,及天然氧化还原剂、有机质等因素利用自身化学性质充当电子供体或受体的角色对土壤中Cr价态进行转化的氧化还原机理,以及不同影响因素之间的相互作用关系,从而可以全面理解土壤中Cr价态转化的行为机制。此外,在对Cr价态影响因素深入了解的基础上,总结了以生物炭和纳米材料为代表的先进修复技术方法,这些材料和方法由于能够将Cr(Ⅵ) 有效地还原为毒性较小的Cr(Ⅲ),从而降低生态环境风险,因而是一类具有巨大潜在应用价值的修复材料和修复方法,但大规模应用的可行性及其修复效果仍需要进一步验证。
要点(1) 土壤中的Cr(Ⅵ)主要以铬酸盐(CrO4 2−)、氢铬酸盐(HCrO4 − )和重铬酸盐(Cr2O7 2−)等氧化离子的形式存在,是土壤中毒性最大的Cr价态。
(2) 土壤中Cr价态受Eh、有机质等多种因素影响,这些因素可以促进或抑制Cr(Ⅵ)的还原。
(3) 生物炭和纳米材料等新型修复技术能够将Cr(Ⅵ)有效地还原为低毒性的Cr(Ⅲ),是治理Cr(Ⅵ)污染的一种可行技术方案。
HIGHLIGHTS(1) Cr(Ⅵ) in soil mainly exists in the form of oxidized ions such as chromate (CrO4 2− ), hydrogen chromate (HCrO4 − ), and dichromate (Cr2O7 2− ), and is the most toxic Cr valence state in soil.
(2) The valence state of Cr in soil is affected by Eh, organic matter and other factors, which can promote or inhibit the reduction of Cr(Ⅵ).
(3) New remediation technologies such as biochar and nanomaterials can effectively reduce Cr(Ⅵ) to low toxicity Cr(Ⅲ), which is a feasible technical solution for treating Cr(Ⅵ) pollution.
Abstract:Chromium (Cr) pollution in soil is a global environmental problem, and hexavalent chromium [Cr(Ⅵ)] has become a focus of attention due to its high toxicity and carcinogenicity. Cr in soil mainly exists in the form of Cr(Ⅲ) and Cr(Ⅵ), and the transformation between the two is influenced by factors such as soil pH, redox potential (Eh), natural redox agents, organic matter, and microorganisms. This article provides an overview of the global pollution status and sources of Cr in soil, as well as the different valence states and toxicity characteristics of Cr in soil. It also analyzes the redox mechanisms of chromium valence state transformation in soil affected by different factors, as well as the interactions between different factors. In addition, through a deep understanding of the factors affecting the valence state of Cr, advanced remediation techniques represented by biochar and nanomaterials have emerged. These methods can effectively reduce Cr(Ⅵ) to less toxic Cr(Ⅲ), thereby reducing ecological and environmental risks. Therefore, they are a potentially valuable remediation material and technique. However, the feasibility and effectiveness of large-scale applications still need further verification. The BRIEF REPORT is available for this paper at http://www.ykcs.ac.cn/en/article/doi/10.15898/j.ykcs.202401180007.
-
Keywords:
- chromium pollution /
- chromium valence state /
- natural redox agent /
- organic matter; remediation technology
This page contains the following errors:
error on line 1 at column 32: Entity 'nbsp' not definedBelow is a rendering of the page up to the first error.
-
铬(Cr)属于天然存在的过渡元素,是一种显著影响土壤环境的潜在有毒重金属,随着人类活动的加剧,土壤中Cr的浓度在不断上升[1-3],植物对Cr的吸收也随之增加,从而导致人类通过食物链摄入的Cr也会增多,此外,人类还会通过吸入和皮肤接触等方式摄入环境中的Cr,当Cr在人体内积累到一定水平时,会对人体健康产生严重影响[4-6]。随着土壤中Cr浓度的增加,Cr造成的土壤环境污染问题已经引起了广泛的关注。
Cr在自然界中有Cr(Ⅱ)到Cr(Ⅵ)等多种价态[7],在土壤中主要以Cr(Ⅲ)和Cr(Ⅵ)的价态存在。这两种价态的Cr具有不同的毒理学特征,Cr(Ⅵ)比Cr(Ⅲ)更具危险性,毒性更高[8],可造成DNA突变和染色体损失[9],已被确认为致癌和致突变物质[10]。土壤中的Cr(Ⅲ)和Cr(Ⅵ)会受到土壤酸碱度(pH)、氧化还原电位(Eh)、天然氧化还原剂、有机质、微生物的作用,从而发生相互转化[11-16]。这些因素在Cr价态转化的过程中也存在复杂的相互作用。
对于受Cr污染的土壤,通常将Cr(Ⅵ)还原为Cr(Ⅲ)[17],以降低其毒性,从而获得更好的环境效益。生物炭作为一种有机质,由于其丰富的官能团,可实现土壤中Cr(Ⅵ)的还原,被作为修复Cr(Ⅵ)污染土壤的优先选择[18]。除此之外,纳米材料也常搭配生物炭,用于修复Cr(Ⅵ)污染的土壤。
由于不同价态的Cr在毒性和化学行为上存在显著差异,本文阐述了国内外土壤中Cr污染现状、主要来源以及土壤中不同价态Cr的毒性,总结了关于土壤pH、Eh、天然氧化还原剂、有机质、微生物对土壤中Cr价态转变的作用机制以及不同因素之间的相互作用关系,并在此基础上探讨了Cr污染土壤绿色经济的新型修复方法。
1. 国内外土壤中Cr的污染现状
随着全球工业化的迅速发展,土壤Cr污染已成为一个国际性问题。由表1可知,不同国家位于工业区附近的土壤样品出现了不同程度的总Cr或Cr(Ⅵ)污染情况,有的甚至造成了地下水污染。中国关于工业区土壤的Cr污染现象值得关注,具体数据显示,中国工业用地中总Cr浓度跨度极大,从0.74~ 37967.33mg/kg 不等,其中4.15%的土壤样本Cr含量超标(筛选参考值为2500mg/kg)[25]。在2002—2009年期间,工业区土壤中总Cr浓度整体呈上升趋势,而在2009—2021年间则有所下降[25],重污染地区主要集中在中国东部的长三角、环渤海地区、南部的珠三角,以及沿长江和黄河的流域,包括浙江省[26]、安徽省[27]和黑龙江省[28]等工业密集区域。与此同时,中国农田土壤中总Cr的浓度范围为1.48~820.24mg/kg ,其中大约有4.31%和0.12%监测点的Cr浓度分别超过了中国《土壤环境质量标准》(GB15618—2018)筛选值(150mg/kg)和控制值(800mg/kg)。值得注意的是,2011—2016年,农业土壤中总Cr的累积速率相对减缓,这可能是由于中国政府采取了一系列措施调整产业结构,并严格限制了工业废料的排放,从而有效地缓解了农业土壤中Cr污染的程度[29]。
表 1 不同国家土壤Cr污染现状Table 1. Current situation of Cr pollution in different countries研究场地 Cr(Ⅲ)含量
(mg/kg)Cr(Ⅵ)含量
(mg/kg)总Cr含量
(mg/kg)对照标准 是否污染
地下水埃塞俄比亚某制革厂周边
污染区域土壤[19]791.5~1811.4 0.621~0.973 792.47~1812.21 制革厂90公里外某处未受污染土壤样品:Cr(Ⅲ)浓度0.18mg/kg,
Cr(Ⅵ)未检出,总Cr浓度0.18mg/kg是 意大利南部一处往年被长期非法掩埋皮革工业废物的农田[20] — 0.15~11.18 48~6831 意大利议会制定的关于土壤中Cr(Ⅵ)筛选值2mg/kg,
总Cr筛选值150mg/kg未评估 中国重庆某铬盐生产场地
遗留旧址[21]— 168.8~203.4 — 《土壤环境质量标准》
(GB 36600—2018)限值5.7mg/kg未评估 中国天津原同生化工厂残渣垃圾堆放场地及周边表层土壤[22] — — 8571.4~10711.4 《土壤环境质量标准》
(GB 15618—2018) 限值250mg/kg是 中国宁夏回族自治区某煤化
化工厂周边土壤[23]— 6.480~11.750 73.800~107.080[24] 中国土壤Cr(Ⅵ)背景值6.100mg/kg;宁夏土壤Cr(Ⅵ)背景值6.000mg/kg 未评估 注:“—”表示数据缺失。 2. 土壤中Cr的来源
自然活动会为土壤带来重金属Cr。土壤中Cr的浓度增加通常与自然界中某些类型的岩石有关,例如蛇纹岩、玄武岩及花岗岩等,这些岩石中的Cr浓度分别可达大约2400mg/kg、200mg/kg和10mg/kg。同时,由于风化作用会导致岩石中Mg等可溶解性元素的浸出和流失,而Cr和Fe等较难溶解的元素则留在土壤中,从而导致土壤中Cr的浓度升高(平均浓度达到了2650mg/kg)。此外,富含Cr2O3的矿物,如铬铁矿(Cr含量大于35%)和磁铁矿(Cr含量小于15%),也是土壤中Cr的重要来源[30-31]。其他自然活动,如火山喷发也会给土壤引入新的Cr,例如1991年菲律宾皮纳图博火山喷发,释放了大约5.5km3的火山灰,为土壤环境带来约55万吨Cr[32]。
工业生产是土壤中Cr的主要人为来源之一[33]。随着现代工业的发展,Cr在土壤中的浓度不断积累和上升[1]。铬铁作为一种重要的合金,是由铬铁矿(FeO·Cr2O3)通过高温还原法制备的,在这个过程中不仅产生铬铁合金,还会生成大量含Cr的炉渣和高浓度Cr粉尘。这些炉渣含有2%~12%的以氧化物和金属形式存在的Cr,由于炉渣经常被随意废弃,导致Cr浸出进入土壤。铬铁粉尘中可浸出Cr(Ⅵ)浓度超过多个国家饮用水中Cr(Ⅵ)的标准限值(0.05mg/L)[34]。此外,制革工业通常可以产生多达75000m3的含Cr废水(Cr含量为2000~5000mg/L),远超世界卫生组织对于工业废水中Cr含量的规定值(2.0mg/L),这些未经妥善处理的含Cr废水一旦排入环境中,将对土壤产生严重污染[35]。
农业活动中使用的农药和化肥也会造成土壤Cr污染[36]。例如,一些落叶剂的有效成分中含有重铬酸钠(Na2Cr2O7),可能会在过量使用的情况下造成土壤Cr(Ⅵ)污染[3]。此外,磷肥是农业活动中重金属污染的另一个主要来源,例如过磷酸钙肥料中含有Cd、Cu、Cr等多种重金属。据估测,每公顷土壤每年施用20kg磷肥可引入约25g的Cr[37]。
3. 土壤中Cr的主要存在价态与毒性
Cr是自然界中价态较为丰富的金属元素之一,在土壤环境中主要以Cr(Ⅲ)和Cr(Ⅵ)两种形式存在,这两种形式因其化学性质差异大而展现出不同的生态毒理学特征,Cr(Ⅵ)以其显著的毒性成为环境科学关注的重点。
3.1 土壤中Cr的主要存在价态
在过去的多项研究中,土壤中的Cr根据其在固体颗粒中的赋存状态,通常被划分为酸溶态、可氧化态、残渣态等几种形态,以此来评估其潜在的毒性和生态风险[38-39]。然而,Cr的环境行为与其氧化态密切相关,因此,明确土壤中Cr的具体价态及其各自的毒性相比研究其物理形态更加关键。尽管Cr有多种存在价态——Cr(Ⅱ)到Cr(Ⅵ),但在土壤环境中,Cr(Ⅲ)和Cr(Ⅵ)是最普遍和稳定的价态,其他价态如Cr(Ⅳ)和Cr(Ⅴ),通常是Cr(Ⅲ)和Cr(Ⅵ)氧化还原过程中的中间产物。土壤中的Cr(Ⅲ)主要以铬铁矿(FeO·Cr2O3)、氢氧化铬[Cr(OH)3]或氧化铬(Cr2O3)的形态存在,具有较低的毒性和迁移性;而土壤中的Cr(Ⅵ)主要以铬酸盐(CrO4 2−)、氢铬酸盐(HCrO4 − )和重铬酸盐(Cr2O7 2−)等氧化离子的形式存在,毒性和迁移性较高[40]。
3.2 Cr(Ⅲ)的毒性与危害
Cr(Ⅲ)在自然环境中的生态毒性较为复杂。对于植物而言,Cr(Ⅲ)没有已知的基本营养功能,在低浓度Cr(Ⅲ)存在的环境下植物也可以正常生存,不会对其生长构成直接威胁。而在动物体内,尤其是哺乳动物中,Cr(Ⅲ)作为一种微量营养元素参与脂类和糖类的代谢过程[41]。世界卫生组织推荐的人体每日Cr(Ⅲ)的理想摄入量为50~200μg,过量摄入可能对生物体造成损害[1],这是因为Cr(Ⅲ)虽然不能轻易穿过细胞膜,但可积聚在细胞周围,破坏细胞膜脂质,改变细胞表面形态,进而破坏细胞的完整性和正常功能[35]。不过,相比于Cr(Ⅵ),Cr(Ⅲ)的毒性要低得多。
3.3 Cr(Ⅵ)的毒性与危害
Cr(Ⅵ)是土壤中毒性最高的Cr价态,它不仅对植物生长造成严重影响,还对动物和人体健康构成重大威胁。作为一种强氧化剂,Cr(Ⅵ)可溶于水并穿透细菌和真核细胞的细胞膜,其毒性可达Cr(Ⅲ)的10~100倍。当土壤中Cr(Ⅵ)浓度超过5mg/kg时,便对植物产生严重危害[42],会降低种子萌发率,阻碍蛋白质和核酸合成,并引发植物细胞膜过氧化反应[43],导致植物不同器官超微结构畸形和叶肉细胞损伤,甚者造成植物的死亡[44]。对于人类而言,Cr(Ⅵ)可通过硫酸盐和磷酸盐离子通道进入细胞内部,经还原形成Cr(Ⅴ)、Cr(Ⅳ)等一系列中间产物,这些中间产物会攻击细胞和其他重要生物分析,诱导活性氧(ROS)的生成,如超氧化物(O2−)、过氧化氢(H2O2)和羟基自由基(•OH)等,进而引发细胞损伤甚至癌变,是A类致癌物之一[45]。此外,Cr(Ⅵ)还能在母体胎盘组织中积累,造成氧化应激,增加细胞凋亡,影响胎儿发育,导致新生儿出现各种健康问题,如呼吸困难、黄疸及其他先天性疾病[46]。
4. 土壤中Cr价态的影响因素
Cr(Ⅲ)和Cr(Ⅵ)是土壤中最常见的两种Cr价态,其中,Cr(Ⅵ)因其较高的毒性及较强的迁移性而成为环境修复的重点对象。Cr(Ⅵ)向Cr(Ⅲ)的转变不仅降低了Cr的环境风险,还减少了其在生态系统中的迁移性。这一转化过程受到多种因素的影响,包括土壤pH、Eh、天然氧化还原剂、有机质以及微生物活动等[47]。
4.1 土壤pH和Eh对土壤Cr形态和价态的影响
土壤pH和Eh作为土壤的基础理化特性,直接影响土壤中Cr的存在形态与价态转化过程。
4.1.1 土壤pH对土壤Cr形态的影响
由于H+和OH−离子浓度不同,决定了Cr(Ⅲ)在不同的pH区间呈现出不同的存在形态[48]。在pH 0~4的酸性条件下,Cr(Ⅲ)倾向于与氨、硫酸盐、尿素、水以及有机酸等形成各种不溶的六配位复合物。当pH值升高至4~6时,Cr(Ⅲ)会形成诸如Cr(OH)2 +、Cr(OH)2+以及Cr(OH)3等水解产物,这些产物不易溶解,并且对有机物质表现出一定的亲和力。若进一步提高pH值,当pH>6时,Cr(Ⅲ)会形成稳定的Cr(OH)3沉淀。而当pH值继续上升至9以上,Cr(OH)3沉淀则会转变为可溶的Cr(OH)4 −络合物[49]。
对于Cr(Ⅵ),其形态同样受到pH值的严格控制。当pH值在6.5~12之间时,Cr(Ⅵ)主要以CrO4 2−的形式存在;而pH值在0.7~6.5之间时,Cr(Ⅵ)则表现为Cr2O7 2−和HCrO4 − 的形式;当pH<0.7时,Cr(Ⅵ)将以H2CrO4的形式出现 [49]。
4.1.2 土壤Eh对土壤Cr价态的影响
土壤Eh是衡量其提供或接受电子能力的一个重要指标,它直接影响着土壤的氧化还原状态,进而影响Cr的价态[50]。通常情况下,土壤中的氧化过程在高Eh条件下占据主导地位,而还原过程则在低Eh条件下更加活跃。随着土壤Eh值的降低,还原性条件得以增强,从而促进Cr(Ⅵ)向Cr(Ⅲ)的转化。这种转化导致Cr(Ⅵ)的浓度减少,通过还原形成的Cr(Ⅲ)往往以铬酸盐的形式被土壤胶体所固定。例如,在热带地区高度风化的Oxisols类型土壤中,实施了连续淹水处理,使得土壤表面保持3cm深的水位。在这种条件下,土壤的Eh值从342mV降至−370mV,土壤呈现出强烈的还原性特征。观察发现,随着灌溉周期的延长,土壤中Cr(Ⅵ)浓度显著下降。经过114天的处理后,Cr(Ⅵ)浓度减少了约46%。这表明,在持续的还原条件下,Cr(Ⅵ)可以被有效地还原为Cr(Ⅲ)。相比之下,采用2~3天灌溉周期且水位保持在土壤表面以上0~2cm处的干湿交替处理,则显示出不同的结果。在这种处理方式下,土壤的Eh值在每次淹水后迅速下降,而在下次灌溉前随着土壤的干燥而逐渐回升,Eh值范围在−291~142mV之间变化,因此,土壤在还原状态与氧化状态之间不断切换,导致Cr(Ⅵ)的浓度随灌溉周期的变化而呈现出下降的趋势,然后又因氧化条件的恢复其浓度升高[51]。
以上实例清晰地表明,土壤Eh可以影响土壤中Cr的存在价态,在还原性条件下,Cr(Ⅵ)更容易被还原为毒性较低的Cr(Ⅲ),而在氧化条件下,Cr(Ⅲ)可能会被重新氧化为Cr(Ⅵ)。因此,理解和调控土壤的氧化还原状态是有效地管理Cr污染土壤的关键策略之一。
4.1.3 土壤中的天然氧化还原剂对土壤Cr价态的影响
土壤中的天然氧化还原剂,如锰氧化物(MnOₓ)、过氧化氢(H2O2)等,都具有一定的氧化或还原特性,能够与土壤中的Cr发生一系列复杂的氧化还原反应[52]。
锰氧化物被认为是土壤中一种主要的天然氧化剂,各种类型的锰氧化物均具有显著氧化Cr(Ⅲ)的能力,特别是在土壤的好氧区,各类锰氧化物主导了Cr(Ⅲ)的氧化过程。锰氧化物可以通过溶解氧化、催化氧化和吸附氧化的方式将Cr(Ⅲ)氧化为Cr(Ⅵ)。具体而言,在酸性条件下(pH<6.0),溶解氧化占据了主导地位;而在碱性条件下(pH>8.0),吸附氧化和催化氧化则更加显著[53]。这种氧化作用有助于提高土壤中Cr(Ⅵ)的比例,从而增加Cr(Ⅵ)的迁移性和毒性。
土壤中的过氧化氢(H2O2)在酸性条件下(pH<7.5)表现出还原性,特别是在pH<3时,H2O2可以还原土壤中的Cr(Ⅵ)。然而,在碱性条件下(pH>7.5),H2O2不仅能够直接地氧化Cr(Ⅲ),还能在氧化Mn2+的过程中生成Mn3+和羟基自由基(•OH)。Mn3+和•OH均具有较强的氧化能力,能够进一步将Cr(Ⅲ)氧化为Cr(Ⅵ)。这种机制促进了Cr(Ⅵ)的生成,从而提高了Cr在土壤中的毒性[53]。
在富含Fe的土壤中,由于风化作用,表层土壤中的Fe主要以Fe3+的形式存在。在太阳光的照射下,Fe3+可以被还原为Fe2+,并参与Cr(Ⅵ)的还原过程。然而,对于普通土壤而言,Fe2+在好氧环境中较为罕见,因此其对Cr(Ⅵ)的还原作用较小[54],这意味着在普通土壤中,Cr(Ⅵ)的还原可能更多地依赖于有机质或微生物的生化反应[55]。此外,土壤中的Fe(OH)2 +在pH 2.5~5.5酸性条件下通过光解能够产生大量的羟基自由基(•OH),这些羟基自由基能够直接氧化Cr(Ⅲ),促使其转变为Cr(Ⅵ)。然而,在高pH值条件下,Fe(OH)2 +光解过程中生成的Fe2+能够迅速还原Cr(Ⅵ),从而降低Cr(Ⅵ)的浓度。
通过这些机制可以发现,土壤中的天然氧化还原剂在调节Cr的价态方面发挥着重要作用。了解这些过程有助于人们更好地理解Cr在土壤中的行为模式,并为开发有效的Cr污染治理策略提供科学依据。
4.2 有机质对土壤Cr价态的影响
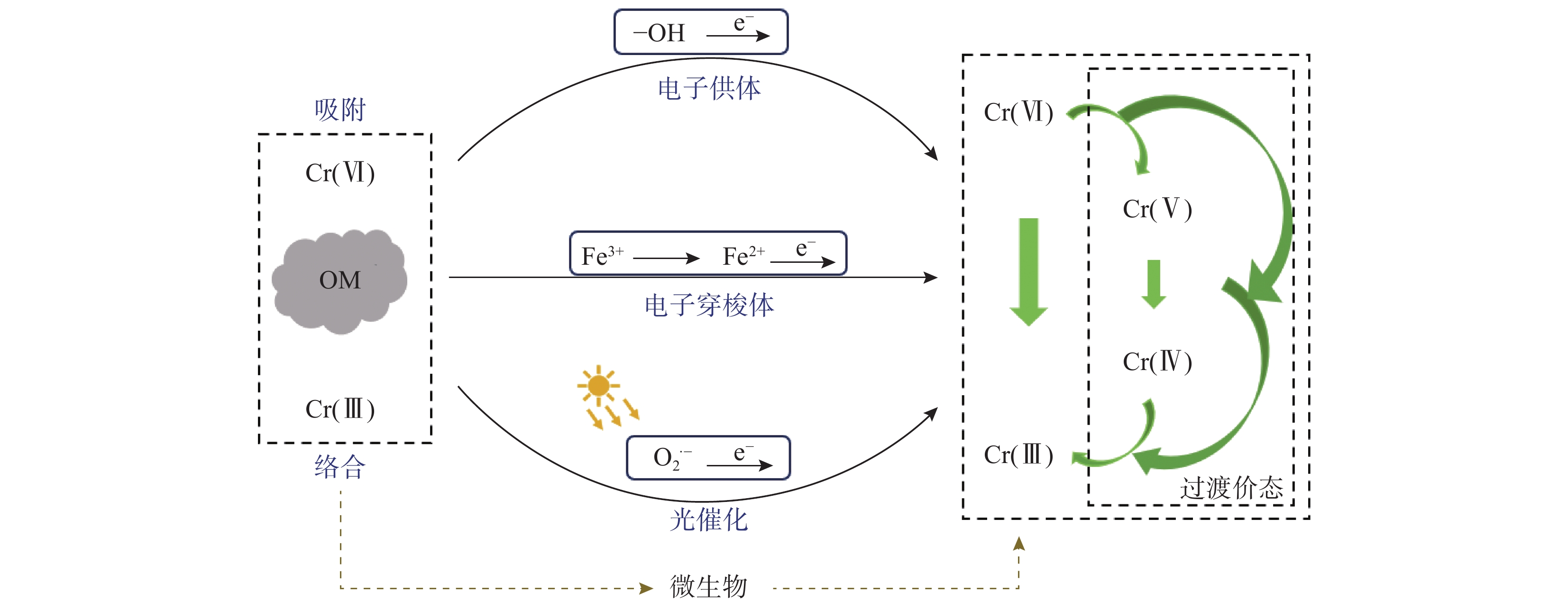
有机质(OM)是土壤的关键组成成分,具有复杂的化学性质,土壤有机质在Cr价态转化中发挥着重要作用。如图1所示,有机质基于“吸附-还原-络合”机理,可将土壤中毒性较大的Cr(Ⅵ)还原为毒性较小的Cr(Ⅲ),并形成稳定的络合物[56-58],因此目前也被作为修复受Cr污染土壤的有效方法之一。此外,有机质还影响着微生物对Cr(Ⅵ)的还原过程。然而,有机质与Cr(Ⅲ)形成的络合物毒性如何,是否比游离的Cr(Ⅲ)毒性更小,还有待进一步验证。
4.2.1 有机质对Cr价态的影响与机理
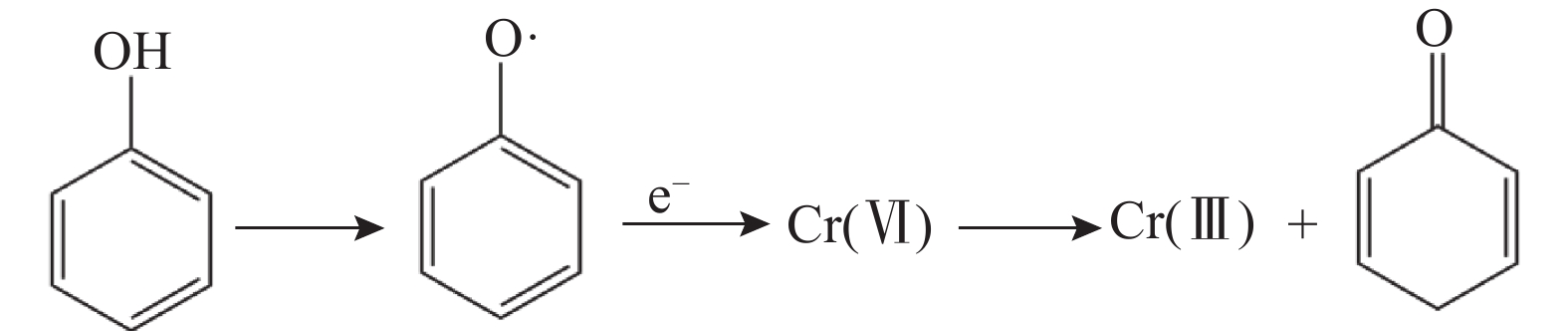
土壤中的有机质作为一种重要的电子供体,可以直接还原Cr(Ⅵ)。其对Cr(Ⅵ)的还原通常遵循“吸附—还原—络合”机制[59]。首先,Cr(Ⅵ)通过静电吸附或离子交换吸附在有机质表面;接着,有机质利用羟基(—OH)等官能团完成对Cr(Ⅵ)的还原;最后,还原生成的Cr(Ⅲ)通过羰基(—C=O)等官能团进行络合作用,形成稳定的配合物并保留在其表面[60-61]。具体来说,有机质中的苯酚和羟基是还原Cr(Ⅵ)的主要电子供体(如图2所示)[62],而羧基和羰基则更可能参与Cr的络合。例如,土壤中普遍存在的腐植酸(HA)和胡敏酸(HM)在还原Cr(Ⅵ)的过程中,利用傅里叶变换红外光谱(FTIR)分析发现,在1708、1626、1226和1078cm−1处的吸光度峰随着时间的推移而显著下降,这些峰分别对应羧基的C=O拉伸振动、羰基的C=O拉伸振动、苯酚的C—O拉伸振动和羟基的C—O拉伸振动。进一步利用X射线光电子能谱(XPS)分析表明,在286.1eV处的峰代表为C—O,在与Cr(Ⅵ)反应60天后,腐植酸和胡敏酸表面苯酚和羟基官能团中的C—O几乎消失,而其他官能团则保持相对不变[63]。
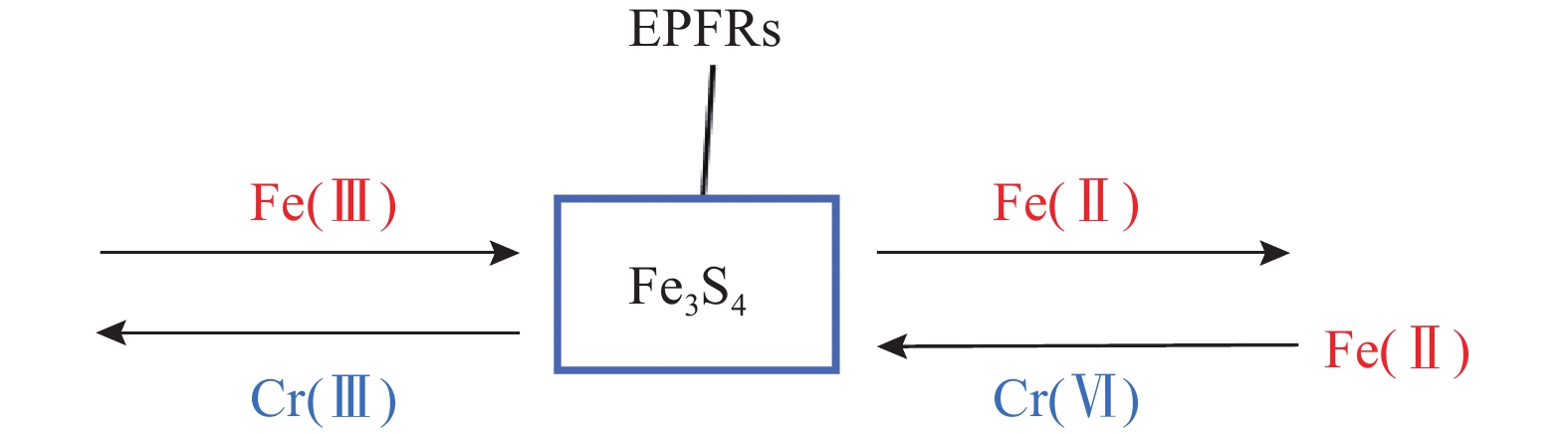
除了作为直接的电子供体,有机质还能作为电子穿梭体间接地还原Cr(Ⅵ)。例如,乳酸虽然其本身作为电子供体单独还原Cr(Ⅵ)的效果不佳,但与生物炭共同存在时,生物炭中的含氧官能团(如羰基)起到“电子载体”的作用,增强了乳酸与Cr(Ⅵ)间的电子传递,使得两者共存时的还原效率显著提高(分别是单独使用乳酸和生物炭的345倍和16.3倍),这表明生物炭作为电子穿梭体的作用比作为电子供体的作用更为显著[64]。此外,磁性灰长石(Fe3S4)改性的生物炭产生的以碳为中心原子的持久性自由基(EPFRs)也可作为电子穿梭体,促进Fe(Ⅲ)/Fe(Ⅱ)循环,进而利用Fe(Ⅱ)还原Cr(Ⅵ)(如图3所示)[65-66]。由于有机质的电子穿梭性质,它还可用作稳定剂,间接地提升土壤中Fe对Cr(Ⅵ)的化学还原效率[67-68]。例如,在利用FeSO4还原Cr(Ⅵ)时,当FeSO4用量为理论值的2.5倍,玉米秸秆改性的生物炭添加量为8%,水土比为50%,土壤停留7天后,Cr(Ⅵ)含量从1000.00mg/kg降至18.909mg/kg[17]。
此外,有机质因其光敏特性[69],亦可通过光催化途径还原土壤中的Cr(Ⅵ)。在紫外光照射下,有机质(OM)会促进持久性自由基(EPFRs)的生成(如图4所示)[70],这些自由基将电子转移给O2,生成O2•−,从而将Cr(Ⅵ)还原为Cr(Ⅲ)[71-72]。ZnFe2O4改性的生物炭含有的B—H基团同样有助于光催化过程中电子的供给,实现Cr(Ⅵ)的还原[73]。有机质还可以作为提高光催化剂性能的优良载体[74]。例如,将钨酸铋(Bi2WO6)负载到尿素改性的生物炭上,可改变生物炭的导电性,提高光电生成的电子空穴对在可见光激发下的分离和迁移,加快光生电子向Cr(Ⅵ)的转移,从而提高Cr(Ⅵ)的还原效率[75]。在传统光催化剂二氧化钛(TiO2)中添加10%(质量分数)的红枣籽衍生生物炭制备新型光催化剂,并加入2.5mmol/L柠檬酸,结果显示,在光照25min后Cr(Ⅵ)的还原效率提升至94.7%,而纯TiO2的转化率仅为72.10%,其中柠檬酸在防止Cr(Ⅲ)向Cr(Ⅵ)的再氧化过程中起到了关键作用[76]。
4.2.2 有机质对Cr生物还原的影响
土壤中的微生物种类繁多,能够通过直接或间接的途径还原土壤中的Cr(Ⅵ)。直接途径主要依靠铬酸盐还原酶的作用,而间接途径则是通过微生物代谢产生的还原物质,如硫化氢(H2S)和Fe2+,来还原Cr(Ⅵ)[52]。微生物在自然环境中广泛存在,由于其生长条件易于控制且具有快速修复环境污染的能力,不会对环境造成二次污染,因此被认为是治理环境污染的有效手段之一。一些长期生活在含Cr环境中的细菌、真菌等微生物对Cr(Ⅵ)的修复更为有效[77],如铜绿假单胞菌[78]、金黄色葡萄球菌[79]和阴沟球菌[80]等都可以实现Cr(Ⅵ)的还原,从而被应用于环境修复治理中。
微生物对Cr(Ⅵ)的还原过程会受到土壤有机质的影响。有机质能够改变土壤中微生物的丰度[81],优化群落结构[82],还可以提高微生物对Cr(Ⅵ)的还原效率。例如,葡萄糖、果糖、乳糖等有机质是Cr(Ⅵ)生物还原过程中常用的电子供体,这些电子供体的加入可以提高异养微生物可溶性还原酶的活性,从而加速Cr(Ⅵ)的生物还原[83]。例如,腐臭链球菌CN32(S. putrefaciens CN32)作为一种能够还原Cr(Ⅵ)的菌种,在土壤腐殖质存在的情况下,能够利用腐殖质作为电子供体,实现微生物对Cr(Ⅵ)的有效还原[84]。此外,蜡样芽孢杆菌WHX-1在浒苔制成的生物炭存在的情况下,其对Cr(Ⅵ)的还原活性也得到了显著提升[85]。研究表明,当添加2mg/L腐植酸时,嗜水杆菌ATCC 7966对Cr(Ⅵ)的还原速度明显加快,比对照组提高了338%[86]。
因此,更多的学者选择在土壤中加入活性炭、海藻酸钠等有机质,以促进微生物的代谢,提高生物降解效率[87]。有机质的存在不仅为微生物提供了必要的营养物质和电子供体,还优化了微生物的生存环境,从而增强了微生物对Cr(Ⅵ)的还原能力。通过这种方式,有机质成为促进微生物活性、提高Cr(Ⅵ)生物还原效率的重要因素之一。
4.2.3 有机质对Cr价态转化的影响因素
有机质作为土壤中影响Cr价态的重要因素之一,在其还原Cr(Ⅵ)的过程中,会受到土壤pH值、铁氧化物等因素的影响。
(1)土壤pH值
有机质在酸性条件下对Cr(Ⅵ)的吸附效果更好。这是因为,在酸性条件下,土壤中的Cr(Ⅵ)主要以HCrO4 − 的形式存在,其吸附自由能较低[88]。同时,有机质在酸性条件下表面具有更多的H+,发生高度质子化,有利于通过静电力吸附阴离子,增强对HCrO4 − 的静电吸引力[89]。而在碱性环境下,Cr(Ⅵ)以CrO4 2−的形式存在,由于OH−的浓度较高,有机质表面的负电荷增加,导致有机质表面的活性位点与CrO4 2−之间产生静电斥力[90]。
此外,有机质对Cr(Ⅵ)的还原速率随着pH值的降低而增加。在pH值较低的条件下,带正电的生物质表面减少了OH−阴离子的竞争性吸附,并且H+的增加可以通过中和Cr(Ⅵ)和有机质之间的负电荷来增强它们之间的键合[91]。例如,在利用纳米零价铁辅助生物炭去除Cr(Ⅵ)的过程中,随着pH值从2增加至8,Cr(Ⅵ)的去除率由99.8%下降至60.2%,再次证明了在酸性条件下有机质对Cr(Ⅵ)的还原效果更佳[92]。
土壤中有机质与Cr(Ⅲ)的络合在不同pH条件下也有所不同。单体络合物普遍存在于pH值较低的酸性有机土壤中,而在pH值较高的碱性有机土壤中,主要是以二聚体或四聚体组成的多核络合物为主[93]。
(2)铁氧化物
铁氧化物的存在对有机质还原Cr(Ⅵ)的过程有两方面的影响。一方面,铁氧化物的存在可能会抑制有机质对Cr(Ⅵ)的还原速率。当外源电子穿梭体蒽醌-2,6-二磺酸盐(AQDS)存在时,腐殖质对Cr(Ⅵ)的还原程度增强[94]。然而,在AH2DS(AQDS的还原形态)与铁氢氧化物[如针铁矿,α-FeO(OH)]共同存在的情况下,Cr(Ⅵ)的还原会受到抑制。当两者比例为1∶1时,抑制效果最为明显,这可能是由于在Fe3+的还原过程中产生了半醌自由基,导致AH2DS与AQDS之间的交叉反应迅速发生,从而减少了AH2DS与Fe3+和Cr(Ⅵ)之间的电子转移,降低了Cr(Ⅲ)的产率[95]。此外,在中性pH的条件下,零价铁存在时,腐植酸不与Cr(Ⅵ)发生相互作用,这可能是由于Cr(Ⅵ)与零价铁之间发生了快速反应[96]。
另一方面,铁氧化物也可能促进有机质对Cr(Ⅵ)的还原速率。例如,腐殖质在酸性条件下还原Cr(Ⅵ)时,会先将Fe3+还原为Fe2+,再利用Fe2+还原Cr(Ⅵ)。腐殖质还原Cr(Ⅵ)的速度在pH≈2时相对较慢,而Fe2+还原Cr(Ⅵ)的速度很快,可以在不到5min的时间内完成[97]。
(3)有机质种类和初始Cr(Ⅵ)浓度
有机质对Cr(Ⅵ)的降解速率还会受到有机质种类和初始Cr(Ⅵ)浓度的影响。土壤中有机质种类繁多,如腐殖质可分为腐植酸(HA)、黄腐酸(FA)和胡敏酸(HM)[91],其中黄腐酸含有最为丰富的官能团[98]。因此,腐殖质对Cr(Ⅵ)的还原速率会随着黄腐酸的浓度和初始Cr(Ⅵ)浓度的增加而增加。
通过以上分析可以看出,土壤中有机质对Cr价态的影响受到多种因素的共同作用,包括土壤pH值、铁氧化物以及其他环境条件。理解这些因素是如何相互作用的,对于设计有效的土壤修复策略至关重要。
5. Cr污染土壤新型修复方法
Cr污染土壤的修复方法众多,总体上可以分为物理法(客土法等)、化学法(化学还原法等)和生物修复法。然而,一些传统的修复方法已不能满足现代修复需求。例如,客土法等物理法存在成本高、适用性差等问题;化学还原法则容易造成二次污染;生物修复法虽然环保,但也存在成本高、耗时长等不足。因此,基于可持续发展理念,目前已开发了一些环境友好、成本低廉且修复效果良好的新型修复技术,如生物炭修复和纳米修复[99-101],均展示了广阔的应用前景。
生物炭修复,是利用生物炭独特的物理化学性质,以修复受Cr污染的土壤。生物炭具有低成本、来源广泛、结构多孔隙、表面积大、官能团丰富且相对稳定等优点,其表面的羧基、羟基和酚类官能团能够有效地吸附和还原Cr(Ⅵ)[102]。然而,未经预处理或改性的原始生物炭的吸附位点较少、功能有限且去除性能较差,难以从环境基质中分离出来,降低了利用的可行性。为了弥补这些不足,进一步提高生物炭的可利用性,通常是将生物炭利用物理、化学、生物等方法进行改性后再运用于Cr污染土壤的修复。例如,使用磷酸(H3PO4)对生物炭进行改性时,可以通过产生水蒸气增加羧基和羟基含量(见式1),从而扩大孔隙结构[103]。且由表2中的案例1和案例2可知,不同的原料及改性方式生产的生物炭,其对Cr(Ⅵ)的去除率也有所不同,因此,可从原料和改性方法入手,进一步优化生物炭对Cr(Ⅵ)的去除效率。
4H3PO4+10C→P4+10CO+6H2O (1)
纳米修复,是利用纳米颗粒(NPs)吸附重金属,并可将其有害价态还原到稳定的金属状态,具有成本较低、处理安全、耗时较短且不会对环境造成二次污染等优点,是一种绿色高效的修复方法[108-109]。目前,以纳米零价铁(Nano zero-valent iron,nZⅥ)为代表的纳米材料已被应用于Cr污染土壤的修复中。由于nZⅥ具有纳米级颗粒,因此具有较大的比表面积(25~35m2/g)和表面能,表现出极强的还原和反应活性。当nZⅥ快速吸附并固定在铁表面的Cr(Ⅵ)时,可通过氧化还原反应将其还原。然而,nZⅥ的化学稳定性较差,容易被氧化并出现结块现象,导致其化学活性较低。为了改善这一现象,通常会选择将纳米零价铁负载到生物炭上,由表2中的案例3和案例4比较可知,纳米零价铁不仅可以提高其稳定性,也可提高Cr(Ⅵ)去除率[110]。
通过上述新型修复技术的应用,不仅能够有效地解决传统修复方法中存在的问题,还能提高修复效率,减少修复成本,并且对环境更加友好。这些技术的发展为Cr污染土壤的治理提供了新的思路和方向。
6. 结论与展望
土壤中Cr(Ⅲ)和Cr(Ⅵ)之间的价态转化受到多种因素的影响。土壤pH值不仅影响Cr的具体存在形态,还影响天然氧化还原剂和有机质对Cr的氧化还原效率,Cr(Ⅵ)在低Eh的土壤条件下,更倾向于被还原为Cr(Ⅲ)。土壤中的天然氧化还原剂可以充当电子供体或受体的角色,影响Cr的价态。有机质由于其复杂的物理化学性质,既可以通过“吸附-还原-络合”的方式直接还原固定土壤中的Cr(Ⅵ),还可以促进Fe(Ⅱ)和Fe(Ⅲ)之间的循环,间接地还原Cr(Ⅵ),此外,有机质还可以利用自身的光敏特性或作为光催化剂的优良载体,参与到Cr(Ⅵ)的还原中。有机质在微生物还原Cr(Ⅵ)的过程中,可以促进可溶性还原酶的活性,提高生物还原的效率。由于Cr(Ⅵ)的高毒性,绝大多数修复方法选择将Cr(Ⅵ)还原为毒性较低的Cr(Ⅲ),并在原有修复方法的基础上进行改进,形成了以生物炭、纳米材料为代表的多种新型绿色高效的修复方法。
关于土壤中Cr污染的研究,未来需要关注以下几个问题:①探究有机质和Cr(Ⅲ)形成的络合物的生态毒性及其在土壤-植物系统中的影响。目前,对于有机质与Cr(Ⅲ)形成的络合物的生态毒性及其在土壤-植物系统中的影响研究较少,这些络合物的稳定性、迁移性和生物可利用性如何,是否比游离的Cr(Ⅲ)毒性更小等问题仍需深入研究。②新型修复方法的实际应用效果和生态影响。目前关于新型土壤中Cr(Ⅵ)修复方法的研究与试验大多停留在实验室阶段,实际场地的运用效果和可能产生的生态影响还有待进一步研究。特别是在大规模应用时,这些修复技术的长期效果、经济可行性和环境安全性都需要进行全面评估。③优化现有修复技术和开发新方法。未来需要进一步优化现有的生物炭修复、纳米修复等技术,并探索更多高效、低成本且环境友好的新型修复方法。通过这些研究,可以更好地理解Cr在土壤中的行为,并为开发更加高效、环保的修复技术提供科学依据,从而保障土壤生态系统的健康和可持续发展。
-
表 1 不同国家土壤Cr污染现状
Table 1 Current situation of Cr pollution in different countries
研究场地 Cr(Ⅲ)含量
(mg/kg)Cr(Ⅵ)含量
(mg/kg)总Cr含量
(mg/kg)对照标准 是否污染
地下水埃塞俄比亚某制革厂周边
污染区域土壤[19]791.5~1811.4 0.621~0.973 792.47~1812.21 制革厂90公里外某处未受污染土壤样品:Cr(Ⅲ)浓度0.18mg/kg,
Cr(Ⅵ)未检出,总Cr浓度0.18mg/kg是 意大利南部一处往年被长期非法掩埋皮革工业废物的农田[20] — 0.15~11.18 48~6831 意大利议会制定的关于土壤中Cr(Ⅵ)筛选值2mg/kg,
总Cr筛选值150mg/kg未评估 中国重庆某铬盐生产场地
遗留旧址[21]— 168.8~203.4 — 《土壤环境质量标准》
(GB 36600—2018)限值5.7mg/kg未评估 中国天津原同生化工厂残渣垃圾堆放场地及周边表层土壤[22] — — 8571.4~10711.4 《土壤环境质量标准》
(GB 15618—2018) 限值250mg/kg是 中国宁夏回族自治区某煤化
化工厂周边土壤[23]— 6.480~11.750 73.800~107.080[24] 中国土壤Cr(Ⅵ)背景值6.100mg/kg;宁夏土壤Cr(Ⅵ)背景值6.000mg/kg 未评估 注:“—”表示数据缺失。 -
[1] Sharma A, Kapoor D, Wang J, et al. Chromium bioaccumulation and its impacts on plants: An overview[J]. Plants-Basel, 2020, 9(1): 100. doi: 10.3390/plants9010100
[2] Pourret O, Hursthouse A. It’s time to replace the term “Heavy Metals”with “Potentially Toxic Elements” when reporting environmental research[J]. International Journal of Environmental Research and Public Health, 2019, 16(22): 4446. doi: 10.3390/ijerph16224446
[3] Rashid A, Schutte B J, Ulery A, et al. Heavy metal contamination in agricultural soil: Environmental pollutants affecting crop health[J]. Agronomy-Basel, 2023, 13(6): 1521. doi: 10.3390/agronomy13061521
[4] Rinklebe J, Antoniadis V, Shaheen S M, et al. Health risk assessment of potentially toxic elements in soils along the Central Elbe River, Germany[J]. Environment International, 2019, 126: 76−88. doi: 10.1016/j.envint.2019.02.011
[5] 林晓梅, 曹玉莹, 赵上勇, 等. 激光诱导击穿光谱技术对土壤中重金属元素Cr的定量分析[J]. 光谱学与光谱分析, 2021, 41(3): 875−879 doi: 10.3964/j.issn.1000-0593(2021)-0875-05 Lin X M, Cao Y Y, Zhao S Y, et al. Quantitative analysis of Cr in soil by laser-induced breakdown spectroscopy[J]. Spectroscopy and Spectral Analysis, 2021, 41(3): 875−879. doi: 10.3964/j.issn.1000-0593(2021)-0875-05
[6] Mortada W I, El-Naggar A, Mosa A, et al. Biogeochemical behaviour and toxicology of chromium in the soil-water-human nexus: A review[J]. Chemosphere, 2023, 331: 138804. doi: 10.1016/j.chemosphere.2023.138804
[7] Prado C, Ponce S C, Pagano E, et al. Differential physiological responses of two Salvinia species to hexavalent chromium at a glance[J]. Aquatic Toxicology, 2016, 175: 213−221. doi: 10.1016/j.aquatox.2016.03.027
[8] Wei Y, Usman M, Farooq M, et al. Removing hexavalent chromium by nano zero-valent iron loaded on attapulgite[J]. Water Air and Soil Pollution, 2022, 233(2): 48. doi: 10.1007/s11270-022-05513-z
[9] Mongaa A, Fulkea A B, Dasguptab D. Recent developments in essentiality of trivalent chromium and toxicity of hexavalent chromium: Implications on human health and remediation strategies[J]. Journal of Hazardous Materials Advances, 2022, 7: 100113. doi: 10.1016/j.hazadv.2022.100113
[10] den Braver-Sewradj S P, van Benthem J, Staal Y C M, et al. Occupational exposure to hexavalent chromium. Part Ⅱ. Hazard assessment of carcinogenic effects[J]. Regulatory Toxicology and Pharmacology, 2021, 126: 105045. doi: 10.1016/j.yrtph.2021.105045
[11] Yan X, Yan Z H, Zhu X Z, et al. Comparing different strategies for Cr(Ⅵ) bioremediation: Bioaugmentation, biostimulation, and bioenhancement[J]. Sustainability, 2023, 15(16): 12522. doi: 10.3390/su151612522
[12] Sayed D, Alturki A A, Farag H, et al. A novel rotating fixed bed batch reactor for hexavalent chromium reduction[J]. Journal of Ecological Engineering, 2022, 23(11): 273−280. doi: 10.12911/22998993/154061
[13] Kang Z, Gao H, Ma X, et al. Fe-Ni/MWCNTs nano-composites for hexavalent chromium reduction in aqueous environment[J]. Molecules, 2023, 28(11): 4412. doi: 10.3390/molecules28114412
[14] Guo H, Chen Y, Hu H, et al. High hexavalent chromium concentration in groundwater from a deep aquifer in the Baiyangdian Basin of the North China Plain[J]. Environmental Science & Technology, 2020, 54(16): 10068−10077. doi: 10.1021/acs.est.0c02357
[15] Deng L Y, Liu F, Ding Z C, et al. Effect of natural organic matter on Cr(Ⅵ) reduction by reduced nontronite[J]. Chemical Geology, 2023, 615: 121198. doi: 10.1016/j.chemgeo.2022.121198
[16] Enbaia S, Eswayah A, Hondow N, et al. Detoxification, active uptake, and intracellular accumulation of chromium species by a methane-oxidizing bacterium[J]. Applied and Environmental Microbiology, 2021, 87(2): e00947−e00920. doi: 10.1128/AEM.00947-20
[17] Pei Y, Yang Y, Chen L, et al. Remediation of chromium-contaminated soil in semi-arid areas by combined chemical reduction and stabilization[J]. Environmental Pollutants and Bioavailability, 2023, 35(1): 2157332. doi: 10.1080/26395940.2022.2157332
[18] Li S, Xie Y, Jiang S, et al. Biochar decreases Cr toxicity and accumulation in sunflower grown in Cr(Ⅵ)-polluted soil[J]. Toxics, 2023, 11(9): 787. doi: 10.3390/toxics11090787
[19] Gezahegn A M, Feyessa F F, Tekeste E A, et al. Chromium laden soil, water, and vegetables nearby tanning industries: Speciation and spatial distribution[J]. Journal of Chemistry, 2021, 2021: 5531349. doi: 10.1155/2021/5531349
[20] Caporale A G, Agrelli D, Rodríguez-González P, et al. Hexavalent chromium quantification by isotope dilution mass spectrometry in potentially contaminated soils from South Italy[J]. Chemosphere, 2019, 233: 92−100. doi: 10.1016/j.chemosphere.2019.05.212
[21] Zhong W, Bai W, Li G. Reduction of hexavalent chromium from soil of the relocated factory area with rice straw hydrothermal carbon modified by nano zero-valent iron (nZVI)[J]. International Journal of Environmental Research and Public Health, 2023, 20(4): 3089. doi: 10.3390/ijerph20043089
[22] Liu Y, Li Y, Hu Y C, et al. Adsorption characteristics and transport behavior of Cr(Ⅵ) in shallow aquifers surrounding a chromium ore processing residue (copr) dumpsite[J]. Journal of Chemistry, 2019, 2019: 4932837. doi: 10.1155/2019/4932837
[23] Zhang K, Yang J, Wang Y, et al. All-region human health risk assessment of Cr(Ⅵ) in a coal chemical plant based on Kriging[J]. Polish Journal of Environmental Studies, 2020, 29(1): 429−439. doi: 10.15244/pjoes/99226
[24] Zhang K, Qiang C D, Liu J. Spatial distribution characteristics of heavy metals in the soil of coal chemical industrial areas[J]. Journal of Soils and Sediments, 2018, 18(5): 2044−2052. doi: 10.1007/s11368-018-1972-9
[25] Li Y, Pan S, Wang L, et al. Soil chromium accumulation in industrial regions across China: Pollution and health risk assessment, spatial pattern, and temporal trend (2002—2021)[J]. Toxics, 2023, 11(4): 363. doi: 10.3390/toxics11040363
[26] Xiang J, Xu P, Chen W, et al. Pollution characteristics and health risk assessment of heavy metals in agricultural soils over the past five years in Zhejiang, Southeast China[J]. International Journal of Environmental Research and Public Health, 2022, 19(22): 14642. doi: 10.3390/ijerph192214642
[27] Wu D, Liu H, Wu J, et al. Bi-directional pollution characteristics and ecological health risk assessment of heavy metals in soil and crops in Wanjiang Economic Zone, Anhui Province, China[J]. International Journal of Environmental Research and Public Health, 2022, 19(15): 9669. doi: 10.3390/ijerph19159669
[28] Wu Z, Zhang D, Xia T, et al. Characteristics, sources and risk assessments of heavy metal pollution in soils of typical chlor-alkali residue storage sites in Northeastern China[J]. PLOS One, 2022, 17(9): e0273434. doi: 10.1371/journal.pone.0273434
[29] Li X, Zhang J, Ma J, et al. Status of chromium accumulation in agricultural soils across China (1989—2016)[J]. Chemosphere, 2020, 256: 127036. doi: 10.1016/j.chemosphere.2020.127036
[30] Kanagaraj G, Elango L. Chromium and fluoride contamination in groundwater around leather tanning industries in Southern India: Implications from stable isotopic ratio δ53Cr/δ52Cr, geochemical and geostatistical modelling[J]. Chemosphere, 2019, 220: 943−953. doi: 10.1016/j.chemosphere.2018.12.105
[31] Chrysochoou M, Theologou E, Bompoti N, et al. Occurrence, origin and transformation processes of geogenic chromium in soils and sediments[J]. Current Pollution Reports, 2016, 2(4): 224−235. doi: 10.1007/s40726-016-0044-2
[32] Kierczak J, Pietranik A, Pedziwiatr A. Ultramafic geoecosystems as a natural source of Ni, Cr, and Co to the environment: A review[J]. Science of the Total Environment, 2021, 755: 142620. doi: 10.1016/j.scitotenv.2020.142620
[33] Briffa J, Sinagra E, Blundell R. Heavy metal pollution in the environment and their toxicological effects on humans[J]. Heliyon, 2020, 6(9): e04691. doi: 10.1016/j.heliyon.2020.e04691
[34] Coetzee J J, Bansal N, Chirwa E M N. Chromium in environment, its toxic effect from chromite-mining and ferrochrome industries, and its possible bioremediation[J]. Exposure and Health, 2020, 12(1): 51−62. doi: 10.1007/s12403-018-0284-z
[35] Pushkar B, Sevak P, Parab S, et al. Chromium pollution and its bioremediation mechanisms in bacteria: A review[J]. Journal of Environmental Management, 2021, 287: 112279. doi: 10.1016/j.jenvman.2021.112279
[36] 贾琼琳, 韩俊艳, 何丹. 土壤中重金属铬污染及其治理方法的研究进展[C]//中国环境科学学会2021年科学技术年会——环境工程技术创新与应用分会场. 北京: 中国环境科学学会, 2021: 354−357, 380. Jia Q L, Han J Y, He D. Research progress of heavy metal chromium pollution in soil and its control methods[C]//China Environmental Science Society 2021 Science and Technology Annual Conference—Environmental Engineering Technology Innovation and Application Sub-forum. Beijing: Chinese Society for Environmental Sciences, 2021: 354−357, 380.
[37] Gupta D K, Chatterjee S, Datta S, et al. Role of phosphate fertilizers in heavy metal uptake and detoxification of toxic metals[J]. Chemosphere, 2014, 108: 134−144. doi: 10.1016/j.chemosphere.2014.01.030
[38] 耿源濛, 张传兵, 张勇, 等. 我国城市污泥中重金属的赋存形态与生态风险评价[J]. 环境科学, 2021, 42(10): 4834−4843. doi: 10.13227/j.hjkx.202101145 Geng Y M, Zhang C B, Zhang Y, et al. Speciation and ecological risk assessment of heavy metal(loid)s in the municipal sewage sludge of China[J]. Environmental Science, 2021, 42(10): 4834−4843. doi: 10.13227/j.hjkx.202101145
[39] 白宇明, 李永利, 周文辉, 等. 典型工业城市土壤重金属元素形态特征及生态风险评估[J]. 岩矿测试, 2022, 41(4): 632−641. doi: 10.15898/j.cnki.11-2131/td.202109030113 Bai Y M, Li Y L, Zhou W H, et al. Speciation characteristics and ecological risk assessment of heavy metal elements in soils of typical industrial city[J]. Rock and Mineral Analysis, 2022, 41(4): 632−641. doi: 10.15898/j.cnki.11-2131/td.202109030113
[40] Ali W, Mao K, Zhang H, et al. Comprehensive review of the basic chemical behaviours, sources, processes, and endpoints of trace element contamination in paddy soil-rice systems in rice-growing countries[J]. Journal of Hazardous Materials, 2020, 397: 122720. doi: 10.1016/j.jhazmat.2020.122720
[41] Bai J, Xun P, Morris S, et al. Chromium exposure and incidence of metabolic syndrome among American young adults over a 23-year follow-up: The CARDIA trace element study[J]. Scientific Reports, 2015, 5: 15606. doi: 10.1038/srep15606
[42] Sharma P, Singh S P, Parakh S K, et al. Health hazards of hexavalent chromium (Cr(Ⅵ)) and its microbial reduction[J]. Bioengineered, 2022, 13(3): 4923−4938. doi: 10.1080/21655979.2022.2037273
[43] Ulhassan Z, Gill R A, Huang H, et al. Selenium mitigates the chromium toxicityin Brassicca napus L. by ameliorating nutrients uptake, amino acids metabolism and antioxidant defense system[J]. Plant Physiology and Biochemistry, 2019, 145: 142−152. doi: 10.1016/j.plaphy.2019.10.035
[44] Kundu D, Dey S, Raychaudhuri S S. Chromium(Ⅵ) induced stress response in the plant Plantago ovata Forsk in vitro[J]. Genes and Environment, 2018, 40: 21. doi: 10.1186/s41021-018-0109-0
[45] Aziz S, Altaf J, Khalil A, et al. Human cancer risk due to chromium and its bioaccumulation in physids in Central Punjab, Pakistan[J]. Environmental Science and Pollution Research, 2023, 30(29): 74223−74235. doi: 10.1007/s11356-023-27664-0
[46] Banu S K, Stanley J A, Taylor R J, et al. Sexually dimorphic impact of chromium accumulation on human placental oxidative stress and apoptosis[J]. Toxicological Sciences, 2018, 161(2): 375−387. doi: 10.1093/toxsci/kfx224
[47] Guo S, Xiao C, Zhou N, et al. Speciation, toxicity, microbial remediation and phytoremediation of soil chromium contamination[J]. Environmental Chemistry Letters, 2020, 19(2): 1413−1431. doi: 10.1007/s10311-020-01114-6
[48] Ertani A, Mietto A, Borin M, et al. Chromium in agricultural soils and crops: A review[J]. Water Air and Soil Pollution, 2017, 228(5): 190. doi: 10.1007/s11270-017-3356-y
[49] Wani K I, Naeem M, Aftab T. Chromium in plant-soil nexus: Speciation, uptake, transport and sustainable remediation techniques[J]. Environmental Pollution, 2022, 315: 120350. doi: 10.1016/j.envpol.2022.120350
[50] Xiao L, Guan D, Chen Y, et al. Distribution and availability of heavy metals in soils near electroplating factories[J]. Environmental Science and Pollution Research, 2019, 26(22): 22596−22610. doi: 10.1007/s11356-019-04706-0
[51] Xiao W, Ye X, Yang X, et al. Effects of alternating wetting and drying versus continuous flooding on chromium fate in paddy soils[J]. Ecotoxicology and Environmental Safety, 2015, 113: 439−445. doi: 10.1016/j.ecoenv.2014.12.030
[52] Shahid M, Shamshad S, Rafiq M, et al. Chromium speciation, bioavailability, uptake, toxicity and detoxification in soil-plant system: A review[J]. Chemosphere, 2017, 178: 513−533. doi: 10.1016/j.chemosphere.2017.03.074
[53] Liang J, Huang X, Yan J, et al. A review of the formation of Cr(Ⅵ) via Cr(Ⅲ) oxidation in soils and groundwater[J]. Science of the Total Environment, 2021, 774: 145762. doi: 10.1016/j.scitotenv.2021.145762
[54] Li B, Yang J X, Sun W T, et al. Carbonization of plant residues decreased their capability of reducing hexavalent chromium in soils[J]. Water Air and Soil Pollution, 2019, 230(12): 300. doi: 10.1007/s11270-019-4353-0
[55] Zhang Z, Ren J, Liang J, et al. New insight into the natural detoxification of Cr(Ⅵ) in Fe-rich surface soil: Crucial role of photogenerated silicate-bound Fe(Ⅱ)[J]. Environmental Science & Technology, 2023, 57(50): 21370−21381. doi: 10.1021/acs.est.3c05767
[56] Hao Y, Ma H, Wang Q, et al. Complexation behaviour and removal of organic-Cr(Ⅲ) complexes from the environment: A review[J]. Ecotoxicology and Environmental Safety, 2022, 240: 113676. doi: 10.1016/j.ecoenv.2022.113676
[57] Bokare A D, Choi W. Advanced oxidation process based on the Cr(Ⅲ)/Cr(Ⅵ) redox cycle[J]. Environmental Science & Technology, 2011, 45(21): 9332−9338. doi: 10.1021/es2021704
[58] Jiang B, Gong Y, Gao J, et al. The reduction of Cr(Ⅵ) to Cr(Ⅲ) mediated by environmentally relevant carboxylic acids: State-of-the-art and perspectives[J]. Journal of Hazardous Materials, 2019, 365: 205−226. doi: 10.1016/j.jhazmat.2018.10.070
[59] Zheng C, Yang Z, Si M, et al. Application of biochars in the remediation of chromium contamination: Fabrication, mechanisms, and interfering species[J]. Journal of Hazardous Materials, 2021, 407: 124376. doi: 10.1016/j.jhazmat.2020.124376
[60] Shi Y, Shan R, Lu L, et al. High-efficiency removal of Cr(Ⅵ) by modified biochar derived from glue residue[J]. Journal of Cleaner Production, 2020, 254: 119935. doi: 10.1016/j.jclepro.2019.119935
[61] Li H, Wang J, Zhao B, et al. The role of major functional groups: Multi-evidence from the binding experiments of heavy metals on natural fulvic acids extracted from lake sediments[J]. Ecotoxicology and Environmental Safety, 2018, 162: 514−520. doi: 10.1016/j.ecoenv.2018.07.038
[62] Xu J, Dai Y, Shi Y, et al. Mechanism of Cr(Ⅵ) reduction by humin: Role of environmentally persistent free radicals and reactive oxygen species[J]. Science of the Total Environment, 2020, 725: 138413. doi: 10.1016/j.scitotenv.2020.138413
[63] Zhang J, Yin H, Wang H, et al. Reduction mechanism of hexavalent chromium by functional groups of undissolved humic acid and humin fractions of typical black soil from Northeast China[J]. Environmental Science and Pollution Research, 2018, 25(17): 16913−16921. doi: 10.1007/s11356-018-1878-5
[64] Xu Z, Xu X, Zhang Y, et al. Pyrolysis-temperature depended electron donating and mediating mechanisms of biochar for Cr(Ⅵ) reduction[J]. Journal of Hazardous Materials, 2020, 388: 121794. doi: 10.1016/j.jhazmat.2019.121794
[65] Wang X, Xu J, Liu J, et al. Mechanism of Cr(Ⅵ) removal by magnetic greigite/biochar composites[J]. Science of the Total Environment, 2020, 700: 134414. doi: 10.1016/j.scitotenv.2019.134414
[66] Odinga E S, Waigi M G, Gudda F O, et al. Occurrence, formation, environmental fate and risks of environmentally persistent free radicals in biochars[J]. Environment International, 2020, 134: 105172. doi: 10.1016/j.envint.2019.105172
[67] Fan Z, Zhang Q, Gao B, et al. Removal of hexavalent chromium by biochar supported nZVI composite: Batch and fixed-bed column evaluations, mechanisms, and secondary contamination prevention[J]. Chemosphere, 2019, 217: 85−94. doi: 10.1016/j.chemosphere.2018.11.009
[68] 陈壮, 梁媛, 赵奔, 等. 改性生物炭对Cr(Ⅵ)的吸附特性研究[J]. 复旦学报(自然科学版), 2021, 60(6): 779−788. doi: 10.15943/j.cnki.fdxb-jns.2021.06.007 Chen Z, Liang Y, Zhao B, et al. Adsorption characteristics and mechanism of modified biochar to Cr(Ⅵ)[J]. Journal of Fudan University (Natural Science), 2021, 60(6): 779−788. doi: 10.15943/j.cnki.fdxb-jns.2021.06.007
[69] Li K, Huang Z, Zhu S, et al. Removal of Cr(Ⅵ) from water by a biochar-coupled g-C3N4 nanosheets composite and performance of a recycled photocatalyst in single and combined pollution systems[J]. Applied Catalysis B-Environmental, 2019, 243: 386−396. doi: 10.1016/j.apcatb.2018.10.052
[70] Peng X X, Gai S, Cheng K, et al. Roles of humic substances redox activity on environmental remediation[J]. Journal of Hazardous Materials, 2022, 435: 129070. doi: 10.1016/j.jhazmat.2022.129070
[71] Zhu S, Huang X, Yang X, et al. Enhanced transformation of Cr(Ⅵ) by heterocyclic-N within nitrogen-doped biochar: Impact of surface modulatory persistent free radicals (PFRs)[J]. Environmental Science & Technology, 2020, 54(13): 8123−8132. doi: 10.1021/acs.est.0c02713
[72] Fang G, Liu C, Wang Y, et al. Photogeneration of reactive oxygen species from biochar suspension for diethyl phthalate degradation[J]. Applied Catalysis B-Environmental, 2017, 214: 34−45. doi: 10.1016/j.apcatb.2017.05.036
[73] Yu Y, An Q, Jin L, et al. Unraveling sorption of Cr(Ⅵ) from aqueous solution by FeCl3 and ZnCl2-modified corn stalks biochar: Implicit mechanism and application[J]. Bioresource Technology, 2020, 297: 122466. doi: 10.1016/j.biortech.2019.122466
[74] Geng A, Xu L, Gan L, et al. Using wood flour waste to produce biochar as the support to enhance the visible-light photocatalytic performance of BiOBr for organic and inorganic contaminants removal[J]. Chemosphere, 2020, 250: 126291. doi: 10.1016/j.chemosphere.2020.126291
[75] Wang T, Liu S, Mao W, et al. Novel Bi2WO6 loaded N-biochar composites with enhanced photocatalytic degradation of rhodamine B and Cr(Ⅵ)[J]. Journal of Hazardous Materials, 2020, 389: 121827. doi: 10.1016/j.jhazmat.2019.121827
[76] Alsaiari M. Biomass-derived active carbon (AC) modified TiO2 photocatalyst for efficient photocatalytic reduction of chromium(Ⅵ) under visible light[J]. Arabian Journal of Chemistry, 2021, 14(8): 103258. doi: 10.1016/j.arabjc.2021.103258
[77] Jalili B, Sadegh-Zadeh F, Jabari-Giashi M, et al. Lead bioimmobilization in contaminated mine soil by Aspergillus niger SANRU[J]. Journal of Hazardous Materials, 2020, 393: 122375. doi: 10.1016/j.jhazmat.2020.122375
[78] Hussain S, Maqbool Z, Shahid M, et al. Simultaneous removal of reactive dyes and hexavalent chromium by a metal tolerant pseudomonas sp. Ws-d/183 harboring plant growth promoting traits[J]. International Journal of Agriculture and Biology, 2020, 23(2): 241−252. doi: 10.17957/IJAB/15.1282
[79] Tariq M, Waseem M, Rasool M H, et al. Isolation and molecular characterization of the indigenous Staphylococcus aureus strain K1 with the ability to reduce hexavalent chromium for its application in bioremediation of metal-contaminated sites[J]. Peerj, 2019, 7: e7726. doi: 10.7717/peerj.7726
[80] Pattnaik S, Dash D, Mohapatra S, et al. Improvement of rice plant productivity by native Cr(VI) reducing and plant growth promoting soil bacteria Enterobacter cloacae[J]. Chemosphere, 2020, 240: 124895. doi: 10.1016/j.chemosphere.2019.124895
[81] Sha C Y, Wu J, Wu J Q, et al. Effects of different fertilizers on soil microbial diversity during long-term fertilization of a corn field in Shanghai, China[J]. Diversity-Basel, 2023, 15(1): 78. doi: 10.3390/d15010078
[82] Jin Q, Zhang Y, Wang Q, et al. Effects of potassium fulvic acid and potassium humate on microbial biodiversity in bulk soil and rhizosphere soil of Panax ginseng[J]. Microbiological Research, 2022, 254: 126914. doi: 10.1016/j.micres.2021.126914
[83] Tang X, Huang Y, Li Y, et al. Study on detoxification and removal mechanisms of hexavalent chromium by microorganisms[J]. Ecotoxicology and Environmental Safety, 2021, 208: 111699. doi: 10.1016/j.ecoenv.2020.111699
[84] Gu B H, Chen J. Enhanced microbial reduction of Cr(Ⅵ) and U(Ⅵ) by different natural organic matter fractions[J]. Geochimica et Cosmochimica Acta, 2003, 67(19): 3575−3582. doi: 10.1016/S0016-7037(3)00162-5
[85] Chen Y, Wu H, Sun P, et al. Remediation of chromium-contaminated soil based on bacillus cereus WHX-1 immobilized on biochar: Cr(Ⅵ) transformation and functional microbial enrichment[J]. Frontiers in Microbiology, 2021, 12: 641913. doi: 10.3389/fmicb.2021.641913
[86] Huang X N, Min D, Liu D F, et al. Formation mechanism of organo-chromium(Ⅲ) complexes from bioreduction of chromium(Ⅵ) by Aeromonas hydrophila[J]. Environment International, 2019, 129: 86−94. doi: 10.1016/j.envint.2019.05.016
[87] Tan H, Wang C, Zeng G, et al. Bioreduction and biosorption of Cr(Ⅵ) by a novel Bacillus sp. CRB-B1 strain[J]. Journal of Hazardous Materials, 2020, 386: 121628. doi: 10.1016/j.jhazmat.2019.121628
[88] Zhuang L, Li Q, Chen J, et al. Carbothermal preparation of porous carbon-encapsulated iron composite for the removal of trace hexavalent chromium[J]. Chemical Engineering Journal, 2014, 253: 24−33. doi: 10.1016/j.cej.2014.05.038
[89] Shaheen S M, Niazi N K, Hassan N E E, et al. Wood-based biochar for the removal of potentially toxic elements in water and wastewater: A critical review[J]. International Materials Reviews, 2019, 64(4): 216−247. doi: 10.1080/09506608.2018.1473096
[90] Liu W, Jin L, Xu J, et al. Insight into pH dependent Cr(Ⅵ) removal with magnetic Fe3S4[J]. Chemical Engineering Journal, 2019, 359: 564−571. doi: 10.1016/j.cej.2018.11.192
[91] Lee S, Roh Y, Koh D C. Oxidation and reduction of redox-sensitive elements in the presence of humic substances in subsurface environments: A review[J]. Chemosphere, 2019, 220: 86−97. doi: 10.1016/j.chemosphere.2018.11.143
[92] Zhu S, Huang X, Wang D, et al. Enhanced hexavalent chromium removal performance and stabilization by magnetic iron nanoparticles assisted biochar in aqueous solution: Mechanisms and application potential[J]. Chemosphere, 2018, 207: 50−59. doi: 10.1016/j.chemosphere.2018.05.046
[93] Gustafsson J P, Persson I, Oromieh A G, et al. Chromium(Ⅲ) complexation to natural organic matter: Mechanisms and modeling[J]. Environmental Science & Technology, 2014, 48(3): 1753−1761. doi: 10.1021/es404557e
[94] 刘爱科, 顾梦琪, 魏书斋, 等. 蒽醌-2,6-二磺酸(AQDS)强化厌氧降解直接蓝15[J]. 净水技术, 2019, 38(2): 63−68. doi: 10.15890/j.cnki.jsjs.2019.02.011 Liu A K, Gu M Q, Wei S Z, et al. Enhanced anaerobic degradation of direct blue 15 by anthraquinone-2,6-disulfonate (AQDS)[J]. Water Purification Technology, 2019, 38(2): 63−68. doi: 10.15890/j.cnki.jsjs.2019.02.011
[95] Tomaszewski E J, Ginder-Vogel M. Decreased electron transfer between Cr(Ⅵ) and AH2DS in the presence of goethite[J]. Journal of Environmental Quality, 2018, 47(1): 139−146. doi: 10.2134/jeq2017.08.0316
[96] Langer M, Jamal M U, Conklin A, et al. Chromium removal in the presence of NOM during Fe(Ⅱ) reductive precipitation for drinking water treatment[J]. Water, 2022, 14(18): 2903. doi: 10.3390/w14182903
[97] Wittbrodt P R, Palmer C D. Effect of temperature, ionic strength, background electrolytes, and Fe(Ⅲ) on the reduction of hexavalent chromium by soil humic substances[J]. Environmental Science & Technology, 1996, 30(8): 2470−2477. doi: 10.1021/es950731c
[98] Song C X, Sun S Q, Wang J T, et al. Applying fulvic acid for sediment metals remediation: Mechanism, factors, and prospect[J]. Frontiers in Microbiology, 2023, 13: 1084097. doi: 10.3389/fmicb.2022.1084097
[99] Bao Z J, Feng H Y, Tu W Y, et al. Method and mechanism of chromium removal from soil: A systematic review[J]. Environmental Science and Pollution Research, 2022, 29(24): 35501−35517. doi: 10.1007/s11356-022-19452-z
[100] Zulfiqar U, Haider F U, Ahmad M, et al. Chromium toxicity, speciation, and remediation strategies in soil-plant interface: A critical review[J]. Frontiers in Plant Science, 2023, 13: 1081624. doi: 10.3389/fpls.2022.1081624
[101] 张兆鑫, 曹宁宁, 李林记, 等. 原位吸附技术修复六价铬污染土壤[J]. 岩矿测试, 2024, 43(2): 302−314. doi: 10.15898/j.ykcs.202307090090 Zhang Z X, Cao N N, Li L J, et al. In situ adsorption technology for remediation of Cr(Ⅵ) contaminated soil[J]. Rock and Mineral Analysis, 2024, 43(2): 302−314. doi: 10.15898/j.ykcs.202307090090
[102] 杨梦楠, 孙晗, 曹海龙, 等. 生物炭-壳聚糖磁性复合吸附剂的制备及去除地下水中铅和铜[J]. 岩矿测试, 2023, 42(3): 563−575. doi: 10.15898/j.ykcs.202208230155 Yang M N, Sun H, Cao H L, et al. Preparation and application of biochar-chitosan magnetic composite adsorbent for removal of lead and copper from groundwater[J]. Rock and Mineral Analysis, 2023, 42(3): 563−575. doi: 10.15898/j.ykcs.202208230155
[103] Peng H, Gao P, Chu G, et al. Enhanced adsorption of Cu(Ⅱ) and Cd(Ⅱ) by phosphoric acid-modified biochars[J]. Environmental Pollution, 2017, 229: 846−853. doi: 10.1016/j.envpol.2017.07.004
[104] Mandal S, Sarkar B, Bolan N, et al. Enhancement of chromate reduction in soils by surface modified biochar[J]. Journal of Environmental Management, 2017, 186: 277−284. doi: 10.1016/j.jenvman.2016.05.034
[105] Murad H A, Ahmad M, Bundschuh J, et al. A remediation approach to chromium-contaminated water and soil using engineered biochar derived from peanut shell[J]. Environmental Research, 2022, 204: 112125. doi: 10.1016/j.envres.2021.112125
[106] Aparicio J D, Lacalle R G, Artetxe U, et al. Successful remediation of soils with mixed contamination of chromium and lindane: Integration of biological and physico-chemical strategies[J]. Environmental Research, 2021, 194: 110666. doi: 10.1016/j.envres.2020.110666
[107] Su H, Fang Z, Tsang P E, et al. Remediation of hexavalent chromium contaminated soil by biochar-supported zero-valent iron nanoparticles[J]. Journal of Hazardous Materials, 2016, 318: 533−540. doi: 10.1016/j.jhazmat.2016.07.039
[108] Ahmed T, Noman M, Ijaz M, et al. Current trends and future prospective in nanoremediation of heavy metals contaminated soils: A way forward towards sustainable agriculture[J]. Ecotoxicology and Environmental Safety, 2021, 227: 112888. doi: 10.1016/j.ecoenv.2021.112888
[109] Mondal P, Anweshan A, Purkait M K. Green synthesis and environmental application of iron-based nanomaterials and nanocomposite: A review[J]. Chemosphere, 2020, 259: 127509. doi: 10.1016/j.chemosphere.2020.127509
[110] Wei Y Z, Chu R, Zhang Q H, et al. Nano zero-valent iron loaded corn-straw biochar for efficient removal of hexavalent chromium: Remediation performance and interfacial chemical behaviour[J]. RSC Advances, 2022, 12(41): 26953−26965. doi: 10.1039/d2ra04650d
-
其他相关附件



 下载:
下载:
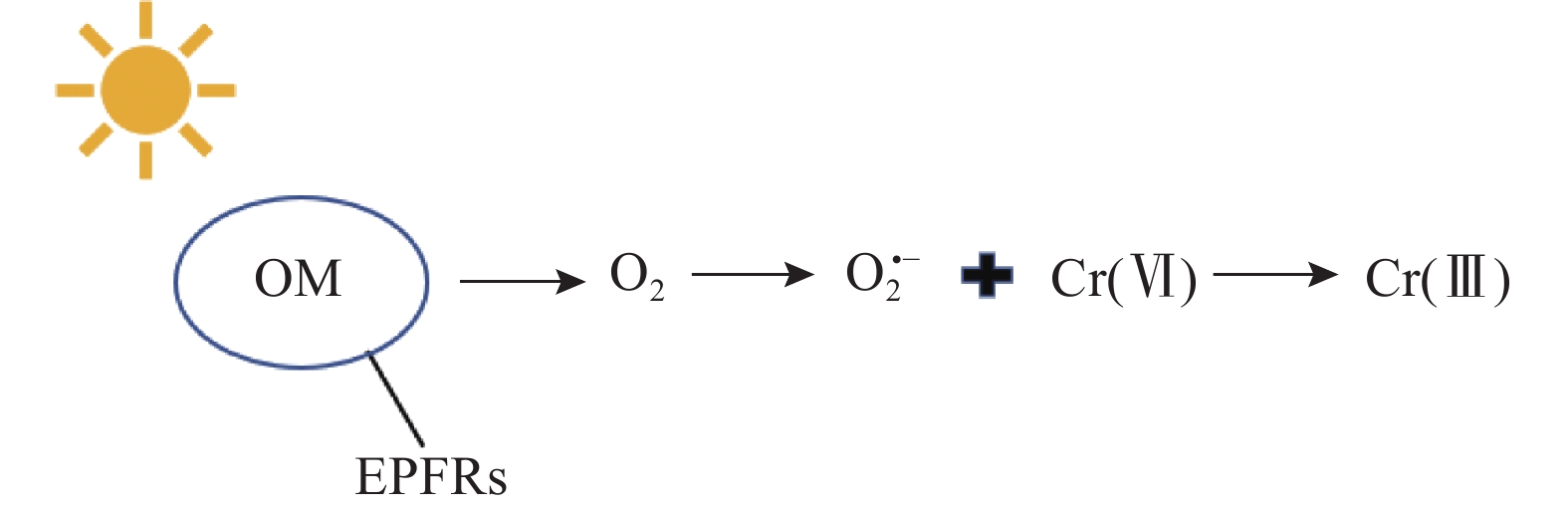
 京公网安备 11010202008159号
京公网安备 11010202008159号