Determination of As, Sb and Bi in Soil and Stream Sediment by a Self-developed Hydride Generation System Coupled with Inductively Coupled Plasma-Optical Emission Spectrometry
-
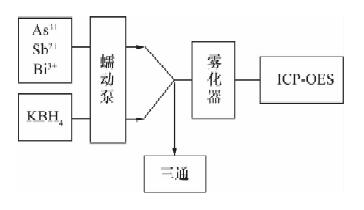
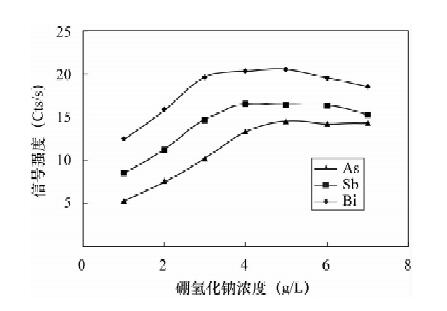
摘要: 氢化物发生法-电感耦合等离子体发射光谱(ICP-OES)联用可以提高仪器测定的灵敏度, 但氢化物发生的化学反应过程不稳定, 导致检测精密度变差。本文设计了一套简易氢化物发生系统, 将样品进样管内径由0.32 mm扩大为0.76 mm, 与还原剂(硼氢化钾)管路通过三通混合, 混合后反应管路内径由0.76 mm扩大为1.14 mm, 反应管长度由30 cm延长至50 cm, 显著增加了待测元素氢化反应的空间和时间, 使氢化反应达到平衡态从而提高了氢化物的稳定性。土壤和水系沉积物样品用盐酸-硝酸水浴浸提、硫脲-抗坏血酸预还原后利用此套系统与ICP-OES联用测定了砷锑铋的含量。砷锑铋的检出限分别为0.35 μg/g、0.33 μg/g、0.25 μg/g, 测定范围分别为1.1~300 μg/g、1.0~100 μg/g、0.75~100 μg/g, 均满足了相关分析要求。Abstract: Hydride Generation (HG) combined with Inductively Coupled Plasma-Optical Emission Spectrometry (ICP-OES) has excellent analytical sensitivity. However, the instable chemical reactions of HG may cause unsatisfactory analytical precision. In this study, a novel and self-made HG system coupled with ICP-OES was developed for measurement of As, Sb and Bi in geological samples. Inner diameter (i.d.) of introduction tubing changed from 0.32 mm to 0.76 mm. Reaction tubing i.d. changed from 0.76 mm to 1.14 mm and length increased from 30 cm to 50 cm. These changes significantly improve the stability of HG reaction by increasing space and time of chemical reactions to reach reaction equilibrium. Arsenic, Sb and Bi were firstly leached from soil and stream sediment using HCl-HNO3 water bath, pre-reduced by thiocarbamide-ascorbic acid mixture, and were finally determined by the modified HG-ICP-OES. The detection limits of this method are 0.35 μg/g, 0.33 μg/g and 0.25 μg/g for As, Sb and Bi, respectively. The linear ranges are 1.1-300 μg/g for As, 1.0-100 μg/g for Sb and 0.75-100 μg/g for Bi, which is sufficient for the measurement of As, Sb and Bi in geological samples.
-
Keywords:
- soil /
- stream sediment /
- As /
- Sb /
- Bi /
- Hydride Generation /
- Inductively Coupled Plasma-Optical Emission Spectrometry
-
长久以来,持久性有机污染物在植物-土壤系统中的环境行为得到研究者的广泛关注。研究者普遍认为,植物在土壤乃至整个环境系统内有机污染物的迁移和转化过程中都起着至关重要的作用[1]。在一些有机污染事故的现场,植物在清除和转移土壤污染物的过程中均有突出表现[2]。Cofield等[3]研究了焦化厂污染土壤中多环芳烃(PAHs)的修复过程,发现种植了羊茅草一年后的土壤中,PAHs总量减少了69%,而同期未种植植物的土壤PAHs总量减少了57%。Gao等[4]通过对比有无种植黑麦草土壤的添加实验发现,45 d处理后种植了黑麦草的土壤中菲和芘的去除率显著高于无植物对照土壤,分别为85%~90%和44%~89%。上述研究结果验证了植物在清除土壤PAHs中的明显作用,但植物-土壤系统PAHs浓度的变化是一个在土壤温度、湿度、植物根系特征、微生物特性等诸多因素影响下的复杂过程,研究者仅通过对比种植植物前后土壤中PAHs的浓度变化来判断植物修复的效率,其结果有失偏颇,甚至会得出完全相反的结论。如Vervaeke等[5]对矿物油污染土壤中PAHs的降解开展了长期研究,一年半后发现种植柳树的土壤中PAHs浓度下降了23%,而未种植柳树的空地土壤中PAHs浓度下降幅度更大,达到32%。如何通过更准确的手段了解植物降解土壤PAHs的进程和效率,成为科学家们当前需要解决的问题。
已有研究发现PAHs可以经过植物的代谢和转化重新释放到空气中,其C、H同位素也会在一定程度上产生分馏[6]。通过测量不同阶段PAHs化合物的C、H分馏比,可以计算PAHs被降解的数量以及降解效率。Lollar等[7]利用碳同位素分馏效应判断出了卤代烃在环境中的生物降解进程和效率。随着气相色谱-同位素比质谱(GC-IRMS)联用技术的成熟,同位素分析技术与分析仪器的精密度不断提高,从而使准确测定目标化合物的同位素组成成为可能[8]。基于以上理论,本研究以玉米作为供试植物,以PAHs为代表化合物,模拟了土壤PAHs的植物降解过程,尝试辅助单体同位素技术(Compound-Specific Isotope Analysis, CSIA)对该过程进行定量表征。
1. 实验部分
1.1 标准和主要试剂
本文所测的目标化合物为美国环境保护署(USEPA)列出的16种优控PAHs化合物。具体包括:萘(Nap)、苊烯(Any)、苊(Ane)、芴(Fle)、菲(Phe)、蒽(Ant)、荧蒽(Fla)、芘(Pyr)、苯并[a]蒽(Baa)、䓛(Chr)、苯并[b]荧蒽(Bbf)、苯并[k]荧蒽(Bkf)、苯并[a]芘(BaP)、茚并[123-cd]芘(I1p)、二苯并[a, h]蒽(Daa)及苯并[ghi]苝(BPe)。16种PAHs混合标准(PAH16 Mixture 610) 购自美国Sigma Aldrich公司,质量浓度为0.2 mg/mL,溶于二氯甲烷:甲苯(1:1) 混合溶剂中。将16种目标化合物标准根据定量曲线的需求配制为2、6、10、20、60、100、160、200 ng/mL共8个浓度水平,测定出各化合物的定量曲线相关系数在0.993~0.999之间,满足样品的定量需求。
5种回收率指示物的混合标准样品,包括Nap-d8、Ace-dl0、Phe-dl0、Chr-d12和Pery-d12,购自美国ULTRA Scientific公司,质量浓度为200 ng/mL,每个样品在提取时的添加水平为50 ng。
实验所需主要溶剂有正己烷、丙酮、二氯甲烷等,均为HPLC级,购自美国Fisher Chemical公司。氧化铝、硅胶均为80~200目,在450℃马弗炉中灼烧6 h备用,使用前需要在140℃下活化16 h,待冷却至室温加入蒸馏水去活,摇匀后静置平衡12 h。然后加入正己烷浸没硅胶,摇匀,磨口瓶平衡过夜后备用。
实验中植物培养及玻璃器皿清洗所用水均为去离子水,其中的目标化合物经检测均为未检出。
1.2 样品采集和室内培养实验方法
在江西南昌郊区的新建县境内选择了4个水稻地块,于每个地块采集5个水稻土样品,采样深度为0~20 cm,每样品采集500 g左右,采样方式见图 1。各样品运回实验室后风干,剔除稻根、田螺壳、小石子等杂质后研磨,混匀后合并为一个大样,作为室内作物培养实验的原始供试土壤。经测试,该土样中16种PAHs总含量为380.8 ng/g(干重)。
对室内培养条件进行摸索和试验后,确立了培养玉米生长的环境条件,即温度保持在24℃,湿度保持30%~40%,光照按照14/10(d/n)的比例条件下,植物生长状况良好。经培育试验,育种移栽后20天,玉米苗已生长至35~40 cm,生物量湿重30 g左右,基本满足实验需求。按照玉米的生长情况,以1周左右为间隔分别采集玉米及土样,在整个玉米培养周期内,共采集4批玉米根、玉米叶、玉米根际土与非根际土样品,考虑未生长植物的土壤情况,留取原始土及相应时期的空白土样作为对照。具体培养和采样方案见表 1。
表 1 玉米室内培养方案及采样说明Table 1. The indoor cultivate and sample programme of maize plants采样
批次采样
时间样品干重(g) 玉米叶 玉米根 根际土 非根际土 对照空白土 第一批 第7天 7.33 3.13 10 10 10 第二批 第12天 7.41 5.29 10 10 10 第三批 第16天 9.84 6.69 10 10 10 第四批 第21天 7.57 4.95 10 10 10 1.3 样品前处理与仪器分析
玉米根、叶和根际土、非根际土、空白土样品经过风干后研磨、过筛,保存于4℃冰箱并于一周内净化、分析及上机测定。测定的目标化合物为16种优先控制的PAHs,结果表示为单位干重含量,16种PAHs化合物的总和表示为∑PAHs。
土壤样品和植物样品的分析参照USEPA方法[9]进行了适当改进,具体流程详述如下。
土壤样品分析:土壤样品风干后研磨过70目筛,取适量(10 g左右)置于索提桶中,加入50 ng回收率指示物,用150 mL正己烷-丙酮(体积比1:1) 混合溶剂抽提16 h。提取液悬蒸至1 mL并转换为正己烷溶剂。采用两层柱净化,层析柱自下往上为12 cm氧化铝和12 cm硅胶。用70 mL正己烷-二氯甲烷(体积比1:1) 混合液洗脱目标物,收集全部洗脱液,浓缩定容至1 mL,转移至样品瓶中待测。
植物样品分析:植物样品用剪刀剪成小块并绞碎后,取适量(5 g左右)与无水硫酸钠一起置于索提桶中,加入50 ng回收率指示物,用150 mL正己烷-丙酮(体积比1:1) 混合溶剂抽提16 h。提取液经0.45 μm滤膜过滤后悬蒸至3 mL并转换为二氯甲烷溶剂。取2 mL过凝胶渗透色谱(GPC)净化,色谱柱规格350 mm×20 mm,填料为硅胶bio-beads,流动相为100%二氯甲烷,流速控制在4 mL/min,收集15~23 min的淋洗液。浓缩至1 mL并转换为正己烷溶剂,转移至进样瓶中待测。
PAHs化合物测定:PAHs化合物用气相色谱-质谱仪(GC/MSD,型号Agilent 6890 /5973) 分析,利用PAHs混标(US Chem Service,PAH16 Mixture 610) 中16种PAHs的GC保留时间和质谱数据库(NIST)对样品中PAHs定性,选取各PAHs的分子、离子,用外标法定量。采用Dtx-5MS色谱柱(30 m×0.25 mm×0.25 μm,美国Restek公司)对16种PAHs化合物进行分离,升温程序为:60℃保持1min,以7℃/min速率升至230℃,之后以15℃/min速率升至280℃,再以25℃/min速率升至310℃,保持5 min。全程用时35.33 min。进样口温度280℃,进样量1 μL,不分流进样。载气N2,纯度99.999%,载气流量2.0 mL/min。空白加标与空白和样品同时提取、分离和检测计算回收率,16种PAHs的回收率在65%~118%之间。实验结果未经回收率校正。
1.4 稳定碳同位素分析
目标化合物PAHs单体的碳同位素比值(δ13C)利用气相色谱-同位素比质谱(GC-IRMS Delta PLUS XL, 美国Thermo Electron公司)经由燃烧过程测定[10, 11]。燃烧炉和还原炉的反应温度分别控制在900℃和630℃。采用DB-5 MS Ultra色谱柱(30 m×0.25 mm×0.25 μm, 美国J & W Scientific公司)分离样品中的PAHs化合物,升温程序为:60℃保持8 min,以3℃/min速率升至120℃,随后以4℃/min速率升至300℃保持8 min,共65 min。进样口温度280℃,不分流进样;载气He,纯度为99.999%,载气流量2.0 mL/min。NiO/CuO/Pt氧化管在使用前在940℃下氧化12 h。
稳定碳的同位素比值13C/12C表示为δ13C,单位为‰,即:
δ13C =(R样品/R标准-1)×1000
式中:R样品和R标准分别表示样品和标准中PAHs的13C/12C比值。所有化合物的δ13C值均是相对于Vienna PeeDee Belemnite标准(δ13CVPDB)的比值。
同位素比值测定期间,首先连续进6个以上PAHs的标准样品,以检查仪器的稳定性。其后定期穿插标样,检查仪器的灵敏度和信号的稳定性。6次进样得到的各化合物稳定碳同位素比值(δ13C)的相对标准偏差位于0.39%~6.7%之间[12]。仪器在样品测定期间稳定,测得的PAHs碳同位素比值可靠。
2. 结果与讨论
2.1 土壤中的多环芳烃降解动态
将玉米生长的第7、12、16天和第21天采集的样品分别记为第一批、第二批、第三批和第四批样品,各时期土壤样品中PAHs的浓度及总有机碳的信息见表 2。培养所用的玉米原始土及分4批收集的空白土、根际土、非根际土样品中16种PAHs的浓度总和(∑PAHs)平均分别为380.8 ng/g、(281.5±34.7) ng/g、(272.2±11.6) ng/g和(299.8±37.9) ng/g。土壤总有机碳平均含量分别为原始土0.89%、空白土0.90%、根际土0.95%及非根际土0.85%。经过植物(玉米)的根系降解作用后,根际土和非根际土中的PAHs都比原始土有所降低,但趋势并不明显。没有种植植物的空白土壤中总的PAHs含量也有所降低。可以推断,在本次培养周期内,植物对土壤中PAHs的降解与消除作用并不明显;在没有外来源加入的情况下,土壤中的PAHs经过挥发过程、水的淋滤、微生物降解等作用其含量会自然逐渐降低。
表 2 不同生长时期土壤中PAHs浓度及有机碳含量Table 2. Concentrations of PAHs and TOC in soil samples during 4 sample periodsPAHs化合物 非根际土(ng/g,干重) 根际土(ng/g,干重) 空白土(ng/g,干重) 原始土
(ng/g,干重)第一批 第二批 第三批 第四批 第一批 第二批 第三批 第四批 第一批 第二批 第三批 第四批 萘 21.54 9.93 17.97 13.10 16.27 10.63 16.97 6.13 21.50 14.92 13.50 11.47 14.92 苊烯 2.23 1.62 2.02 1.65 1.95 2.21 1.94 1.61 2.02 2.25 1.79 1.58 1.56 苊 3.93 nd 3.31 2.51 3.70 2.99 nd 2.62 4.12 3.32 3.13 2.56 2.26 芴 7.56 6.11 5.35 3.49 10.51 9.56 6.84 4.68 8.69 5.34 5.75 4.07 4.66 菲 50.59 42.82 51.47 35.70 50.41 48.41 41.80 38.50 52.76 41.40 41.03 37.14 19.64 蒽 7.18 6.36 7.64 5.25 6.04 6.88 7.51 5.82 7.22 6.37 5.96 5.91 5.23 荧蒽 31.26 27.37 35.10 26.11 23.93 30.54 29.50 29.45 32.16 28.71 22.15 24.29 23.52 芘 40.50 36.94 45.75 33.91 30.99 35.77 36.79 36.78 40.43 37.56 29.14 34.14 36.52 苯并[a]蒽 28.21 26.09 32.31 25.65 21.00 25.53 25.78 27.10 29.35 27.72 23.05 24.87 30.78 䓛 32.49 29.63 36.78 29.30 24.24 28.44 29.17 30.86 33.43 31.23 27.27 29.67 37.69 印并[123, cd]芘 2.07 5.28 2.06 1.55 1.26 1.52 4.08 1.53 1.97 1.54 1.70 1.20 42.80 苯并[a]芘 6.37 nd 6.93 5.16 4.51 5.33 nd 5.86 6.05 6.16 5.15 5.49 13.77 苯并[ghi]苝 20.92 21.24 23.27 18.78 14.42 18.13 21.00 19.92 20.56 21.07 16.91 18.81 81.22 苯并[b]荧蒽 7.79 8.30 9.05 7.57 5.53 7.25 7.78 8.01 8.02 8.24 6.05 6.82 84.64 苯并[k]荧蒽 31.98 29.66 36.81 29.16 23.30 27.88 27.25 30.96 31.85 32.12 26.45 28.86 31.34 苯并[a, h]蒽 24.21 23.67 27.73 23.04 17.64 21.15 21.21 23.72 25.09 25.48 19.86 21.93 50.30 ∑PAHs 318.80 275.00 343.52 261.94 255.71 282.23 277.64 273.54 325.22 293.43 248.89 258.80 480.83 2, 3环PAHs 93.03 66.84 87.77 61.70 88.89 80.69 75.06 59.35 96.32 73.60 71.16 62.72 48.27 4, 5, 6环PAHs 225.78 208.17 255.79 200.25 166.83 201.54 202.58 214.19 228.91 219.84 177.74 196.08 432.59 总有机碳(%) 0.82 0.86 0.87 0.83 0.94 1.01 0.97 0.87 nd 0.94 0.91 0.84 0.88 注:“nd”表示未检出。 从4个采样时期土壤中不同组分PAHs的动态变化来看,3环化合物(苊烯、苊、芴、菲、蒽)的浓度下降趋势最为显著(图 2)。如表 3所示,常温下的2、3环PAHs化合物其辛醇-水分配系数(Kow)和辛醇-气分配系数(Koa)都明显低于4环以上化合物(荧蒽、芘、苯并[a]蒽、䓛、苯并[b]荧蒽、苯并[k]荧蒽、苯并[a]芘、茚并[123-cd]芘、二苯并[a, h]蒽及苯并[ghi]苝)[13],因此2、3环化合物与土壤有机质结合相对松散,更易从土壤基质中向外逃逸,从而使得这类化合物相对容易从土壤中得到清除。此外,作物的根、叶部位也倾向于富集2、3环等低环PAHs化合物[14],以植物吸收和转运的方式使土壤中的该类化合物含量减少[15]。
表 3 16种PAHs化合物的基本理化参数Table 3. The physical-chemical parameters of 16 PAHs compoundsPAHs
化合物logKow logH logKoa PAHs
化合物logKow logH logKoa 萘 3.37 1.6335 5.1308 苯并[a]蒽 5.91 -0.991 10.296 苊烯 4.00 1.0626 6.3317 䓛 5.86 -0.975 10.229 苊 3.92 1.3802 5.934 苯并[b]荧蒽 5.80 -1.268 10.462 芴 4.18 0.9294 6.6448 苯并[k]荧蒽 6.00 -0.955 10.349 菲 4.57 0.6021 7.3622 苯并[a]芘 6.04 -2.046 11.480 蒽 4.54 0.7782 7.1561 茚并[123-cd]芘 6.50 - - 荧蒽 5.22 -0.181 8.7954 二苯并[a, h]蒽 6.75 -2.155 12.299 芘 5.18 0.0414 8.5329 苯并[ghi]苝 6.50 -3.000 12.894 2.2 玉米中的多环芳烃动态
玉米叶和玉米根中的PAHs在4次采样期间的浓度情况见图 3,在玉米生长的第7、12、16天和第21天采集的样品分别记为样品1、2、3和样品4。玉米叶中的∑PAHs随着玉米的生长呈现逐渐增高的趋势,其中又以3环化合物的浓度升高趋势最为显著;而玉米根中的∑PAHs则逐渐降低,且以5、6环化合物的降低趋势最为显著。对应时段的玉米根际土中PAHs总量和3环PAHs浓度均呈减少趋势,说明玉米植物通过根系吸附、吸收及玉米叶的吸收转运等过程对土壤PAHs产生了一定的清除作用。
2.3 多环芳烃稳定碳同位素的分馏特征
由于样品中目标化合物含量普遍较低,而GC-IRMS的检测限偏高,在测定土壤样品PAHs的碳同位素时存在一定难度,只有苊烯、芴、苊、菲、荧蒽和芘等6种化合物的δ13C值被检出。本研究以这6种化合物为代表,探讨土壤PAHs在植物降解过程中的浓度变化以及稳定碳同位素的分馏特征。
玉米培养过程中土壤PAHs的碳同位素比值(δ13C)见表 4。各样品中PAHs的δ13C值在-34.31‰~-23.95‰之间,其中以菲的δ13C值较轻,平均值为-31.02‰,苊烯的δ13C值较重,平均值为-27.48‰。有文献报道,在有生物质、煤、汽油等PAHs来源的表层土壤中,化合物的δ13C值一般介于-34‰~-15‰之间[16],与本研究得到的土壤中PAHs的δ13C值范围与之相近。
表 4 玉米培养过程中土壤PAHs的碳同位素特征Table 4. The fractionation of PAHs carbon isotope during the maize cultivating process样品编号 δ13C(‰) 苊烯 苊 芴 菲 荧蒽 芘 非根际土1 -26.47 -29.52 -29.97 -29.68 -33.85 -26.52 非根际土2 -24.60 -27.94 -28.38 -25.53 -24.82 -30.20 非根际土3 -26.87 -31.20 -25.70 -28.08 -26.94 -34.42 非根际土4 -29.37 -30.14 -32.16 -34.31 -29.35 -25.98 根际土1 -26.42 -29.08 -28.14 -29.65 -28.25 -30.17 根际土2 -24.58 -26.46 -24.97 -26.69 -29.08 -31.29 根际土4 -28.20 -30.53 -33.45 -39.63 -28.40 -27.27 空白土2 -26.21 -29.68 -26.15 -30.92 -28.91 -23.95 空白土3 -32.28 -30.27 -27.80 -30.79 -30.07 -26.79 空白土4 -29.27 -29.85 -28.59 -34.89 -29.57 -27.60 有研究者发现,低环的PAHs化合物如萘等,在自然降解过程中,可以观察到2‰~8‰的碳同位素分馏变化[17]。如果采用氢的同位素分馏加以表述,将会看到更显著的分馏变化[18]。本研究在玉米的培养过程中,根际土、非根际土及空白土中各PAHs化合物的碳同位素均未发现明显规律的分馏效应。O’Malley等[19]在开展PAHs的生物降解试验时,也没有检测到稳定碳同位素的分馏变化。研究者认为,PAHs等大分子化合物在生物降解过程中碳的同位素分馏不是很明显。将本研究中土壤PAHs的降解反应程度ln(1-f)与化合物的浓度变化ln(c/c0)作相关性分析(图 4),亦未发现各化合物的碳同位素分分馏与浓度变化之间存在明显趋势。
O’Malley等[20]研究认为,PAHs单体化合物,尤其是4、5环化合物,在挥发、光解及生物降解过程中δ13C值很少发生变化。而且,实际样品中PAHs碳同位素的测定存在很大的不确定性,也存在实际环境PAHs的降解过程复杂,可能不具备一般规律等因素影响。目前,关于PAHs单体同位素在生物降解中的体现特征多集中在模拟实验阶段,在实际环境的研究中还需要更高的测试精度作为保证。
3. 结语
本文研究了玉米植物对根系土壤中PAHs浓度的影响,并通过分析土壤中PAHs单体化合物的同位素分馏特征,对PAHs的降解过程进行了定量解释,得到了以下主要结论。
(1) 玉米根对土壤的PAHs有一定清除作用,尤其对3环化合物的清除作用明显。
(2) 玉米培养过程中土壤PAHs的碳同位素比值(δ13C)在-34.31‰~-23.95‰之间,与其他研究中表层土壤PAHs的δ13C值相当。各化合物的δ13C值在整个玉米培养期间未见明显变化规律。
(3) PAHs单体化合物,尤其是4、5环化合物,在玉米降解过程中的碳同位素分馏与浓度变化之间未发现明显关系。由于实际样品具有基质复杂、目标化合物含量低等限制因素,δ13C值的测定存在较大的误差和不确定性,因此,在现有条件下对实际环境中PAHs的植物降解进行定量监测还需要更高的测定精度作为保证。
(4) 由于3环以下的PAHs化合物更倾向于被降解和清除,且其碳、氢同位素分馏情况更容易被观察到,今后可以有针对性地开展应用CSIA技术探讨这类单体化合物降解过程的研究,预期将得到具有一定规律的有用信息。
-
表 1 样品处理方式的对比
Table 1 omparison of analytical results of As, Sb and Bi with differents pretreatment methods
元素 GBW07406(土壤) GBW07430(土壤) GBW07312(水系沉积物) 四酸溶矿
测定值
(μg/g)水浴浸提
测定值
(μg/g)标准值
(μg/g)四酸溶矿
测定值
(μg/g)水浴浸提
测定值
(μg/g)标准值
(μg/g)四酸溶矿
测定值
(μg/g)水浴浸提
测定值
(μg/g)标准值
(μg/g)As 198 218 220 16.8 19.3 18 105 116 115 Sb 53.4 58.9 60 1.55 1.85 1.9 20.4 25.3 24.5 Bi 45.1 51.4 49 1.23 1.51 1.44 8.34 11.1 10.9 表 2 方法精密度和准确度
Table 2 Precision and accuracy tests of the method
标准物质
编号元素 含量(μg/g) RSD
(%)相对误差
(%)平均值 标准值 GBW07404
(土壤)As 55.4 58.0 6.7 4.4 Sb 6.02 6.30 7.3 4.4 Bi 0.99 1.04 9.6 4.8 GBW07429
(土壤)As 20.6 21.7 5.4 5.0 Sb 2.00 1.90 7.7 5.5 Bi 1.08 1.16 3.9 6.8 GBW07306
(水系沉积物)As 13.5 13.6 4.3 0.7 Sb 1.27 1.25 5.9 1.6 Bi 5.14 5.00 4.6 2.8 GBW07311
(水系沉积物)As 183 188 5.4 2.9 Sb 14.7 14.9 9.3 1.3 Bi 50.3 50.0 4.8 0.6 GBW07312
(水系沉积物)As 115 115 3.3 0.1 Sb 24.5 24.0 6.6 2.0 Bi 10.8 10.9 8.7 0.8 表 3 不同方法测定结果的比较
Table 3 A comparison of analytical results between HG-ICP-OES and HG-AFS
样品编号元素 测定值(μg/g) HG-ICP-OES(本法) HG-AFS 土壤样品1 As 5.25 5.43 Sb 10.4 10.9 Bi 2.66 2.98 土壤样品2 As 23.5 24.4 Sb 6.12 5.85 Bi 6.84 6.53 水系沉积物
样品1As 0.68 0.61 Sb 1.08 0.98 Bi 3.21 3.42 GBW07306
(水系沉积物)As 13.1 14.2 Sb 1.15 1.11 Bi 4.87 5.11 -




 下载:
下载:



 京公网安备 11010202008159号
京公网安备 11010202008159号